

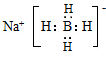 .
.分析 以铁硼矿(主要成分为Mg2B2O5•H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3),由流程可知,加硫酸溶解Fe3O4、SiO2不溶,CaO转化为微溶于水的CaSO4,“净化除杂”需先加H2O2溶液,将亚铁离子转化为铁离子,调节溶液的pH约为5,使铁离子、铝离子均转化为沉淀,则滤渣为氢氧化铝、氢氧化铁,然后蒸发浓缩、冷却结晶、过滤分离出H3BO3,以此来解答.
解答 解:(1)Mg2B2O5•H2O与硫酸反应的化学方程式Mg2B2O5•H2O+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2H3BO3+2MgSO4,为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有提高反应温度或减小铁硼矿粉粒径等,故答案为:Mg2B2O5•H2O+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2H3BO3+2MgSO4;提高反应温度或减小铁硼矿粉粒径;
(2)“净化除杂”需先加H2O2溶液,作用是将亚铁离子氧化为铁离子.然后在调节溶液的pH约为5,目的是使铁离子、铝离子形成氢氧化物沉淀而除去,
故答案为:将亚铁离子氧化为铁离子;使铁离子、铝离子形成氢氧化物沉淀而除去;
(3)NaBH4为离子化合物,含离子键、共价键,其电子式为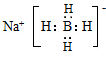 ,故答案为:
,故答案为: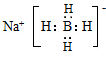 ;
;
(4)以硼酸和金属镁为原料可制备单质硼的化学方程式为2H3BO3$\frac{\underline{\;\;△\;\;}}{\;}$B2O3+3H2O、B2O3+3Mg$\frac{\underline{\;\;△\;\;}}{\;}$2B+3MgO,
故答案为:2H3BO3$\frac{\underline{\;\;△\;\;}}{\;}$B2O3+3H2O、B2O3+3Mg$\frac{\underline{\;\;△\;\;}}{\;}$2B+3MgO.
点评 本题考查混合物分离提纯的综合应用,为高频考点,为2015年高考真题,把握实验流程及发生的反应、混合物分离提纯方法为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
下列各组物质中,所含分子数相同的是
A.1gH2和1gO2 B.5.6LN2(标准状况)和22gCO2
C.9gH2O和0.5molCl2 D.22.4LH2(标准状况)和0.1molN2
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
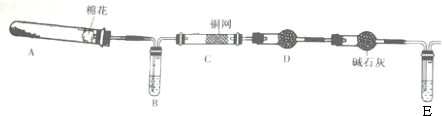
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
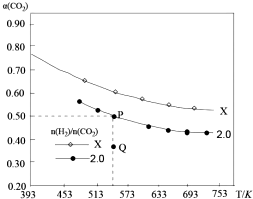 在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | 氢碳比:X<2.0 | |
| C. | 氢碳比为2.0时.Q点v(H2)逆小于P点的v(H2)逆 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4•H2O,再次平衡后a(CO2)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
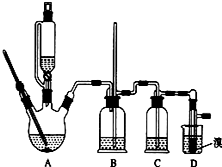 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见如图,相关物质的沸点见附表)其实验步骤为:
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见如图,相关物质的沸点见附表)其实验步骤为:| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
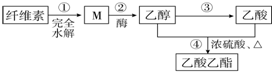
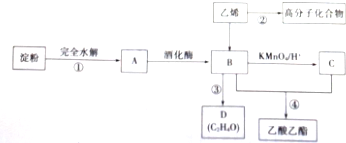
| A. | ③和④都发生了氧化还原反应 | |
| B. | M虽然分子结构中无醛基,但仍然可以发生银镜反应 | |
| C. | 步骤②,1molM完全反应可以生成3mol乙醇 | |
| D. | 若用淀粉替代纤维素,一定条件下也能按照此路线制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
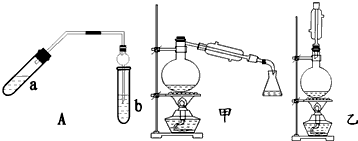
| 实验编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层 的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com