
【题目】硼烯具有优异的电学、力学、热学等属性,将成为继石墨烯之后又一种“神奇纳米材料”。科学家已成功合成多种结构的硼烯,如图为“皱褶”式硼烯的结构。下列说法错误的是( )

A.“皱褶”式硼烯中每个硼原子共用3对电子
B.“皱褶”式硼烯中硼原子达到8电子稳定结构
C.硼烯有望代替石墨烯作电极材料
D.氧化硼的水化物是一种弱酸,与过量OH-反应可生成B(OH)4-或BO2-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物M的合成路线如下图所示:

已知:
(以上R、R’、R’’代表氢、烷基或芳基等)
(1)C中官能团名称为__________,B的化学名称为____________。
(2)F的结构简式为___________,则与F具有相同官能团的同分异构体共_____种(考虑顺反异构,不包含F)。
(3)由G生成H的化学方程式为________________________,反应类型为____________。
(4)下列说法正确的是________________(选填字母序号)。
a.由H生成M的反应是加成反应
b.可用硝酸银溶液鉴别B、C两种物质
c.1 mol E最多可以与4 mol H2发生加成反应
d.1 mol M与足量NaOH溶液反应,消耗4 mo1 NaOH
(5)以乙烯为起始原料,结合已知信息选用必要的无机试剂,写出合成CH3CH=CHCH3的路线________________ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体NH4Br置于密闭容器中,在某温度下,发生反应:NH4Br(s)![]() NH3(g)+HBr(g),2HBr(g)
NH3(g)+HBr(g),2HBr(g)![]() Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
A. 0.5 mol·L-1·min-1B. 2.5 mol·L-1·min-1
C. 2 mol·L-1·min-1D. 1.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国许多城市为了减少燃煤造成的大气污染,对煤做了多方面的改进:
(1)为了除去煤中的含硫化合物,采用FeCl3脱硫,即用FeCl3溶液浸洗煤粉,发生反应如下:FeS2+14FeCl3+8H2O====2FeSO4+13FeCl2+16HCl(已知FeS2中硫元素的化合价为-1价)。
①该反应的氧化剂是____,若有1 mol FeS2被除去,则发生转移的电子的物质的量是___________。
②为了充分利用Fe2+并减少酸(HCl)污染,本方法中可利用工业废铁屑和Cl2让废液重新生成FeCl3。请写出这一过程中有关的离子方程式:______________;_____________________。
(2)“保护环境,就是保护人类自己”。飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降,它与空气的污染物二氧化硫(SO2)接触时,二氧化硫(SO2)会部分转化为三氧化硫(SO3),其污染更加严重。
①飘尘所起的作用可能是______________.
A. 氧化剂B.还原剂C.催化剂D.载体
发生反应的化学方程式为________________________________________________.(如果是氧化还原反应,请用双线桥标出电子转移的方向和数目)
②冶金工业中常用高压电对气溶胶作用,以除去飘尘,减少对空气的污染,这种做法的依据是___.
A. 布朗运动 B.丁达尔现象 C. 渗析 D. 电泳。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中,可逆反应:mA(s)+nB(g) ![]() pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vB∶vC∶vD=n∶p∶q,其中,能说明反应已达到平衡的是 ( )
pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vB∶vC∶vD=n∶p∶q,其中,能说明反应已达到平衡的是 ( )
A. 只有③④B. 只有②③④C. 只有①②③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,又能缓解能源危机。实现CO2资源化再利用的研究工作正在不断进行中。
(1)CO2和H2,合成CH3OH,用非金属催化剂实现CO2电催化还原制备甲醇的反应历程如图所示:
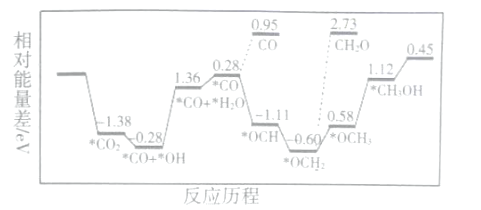
上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中___ (填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C. *OCH2→*OCH3 D.*OCH3→*CH3OH
(2)CO2和H2合成甲酸(HCOOH)其反应为:H2(g)+CO2(g)![]() HCOOH(g)。一定温度下,恒容密闭容器中进行上述反应,测得v正(CO2)随反应时间(t)的变化如图所示。
HCOOH(g)。一定温度下,恒容密闭容器中进行上述反应,测得v正(CO2)随反应时间(t)的变化如图所示。
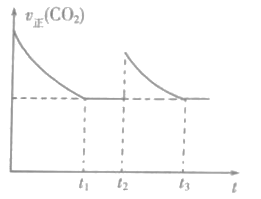
①t2时,改变的条件是充入amolCO2,同时___。
②下列关于t1、t3时刻的说法,正确的是___。
a.平衡常数:K1>K3
b.混合气的平均分子量:![]() <
<![]()
c.混合气中HCOOH的体积分数:V1=V3
③标准平衡常数Kθ=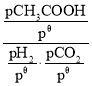 ,其中pθ为标准压强(1×105Pa),pH2、pCO2和pHCOOH为各组分的平衡分压,如pCO2=pxCO2,p为平衡总压,xCO2为平衡系统中CO2的物质的量分数。在标准压强下,向上述容器充入等物质的量的H2和CO2进行反应,测得HCOOH的平衡产率为w,则K=___(用含w字母表示)。
,其中pθ为标准压强(1×105Pa),pH2、pCO2和pHCOOH为各组分的平衡分压,如pCO2=pxCO2,p为平衡总压,xCO2为平衡系统中CO2的物质的量分数。在标准压强下,向上述容器充入等物质的量的H2和CO2进行反应,测得HCOOH的平衡产率为w,则K=___(用含w字母表示)。
(3)O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
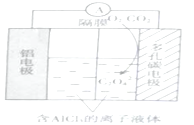
电池正极区发生的反应:①O2+e-=O2-;②___,O2的作用是___。
(4)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的KOH溶液,所得溶液的pH=3,则![]() =___。
=___。
(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示四种化学实验操作的名称按①②③④顺序排列分别为( )

A.过滤、蒸发、蒸馏、萃取(或分液或萃取分液)
B.过滤、蒸馏、蒸发、萃取
C.蒸发、蒸馏、过滤、萃取
D.萃取、蒸馏、蒸发、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a___1×10-14 (填“>”、“<”或“=”![]() ,作此判断的理由是___。
,作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=____。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___,此溶液中各种离子的浓度由大到小的排列顺序:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应X2+3Y2=2XY3的能量变化如图所示,该反应的热化学方程式是( )
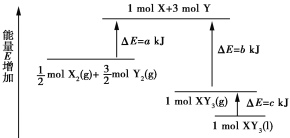
A.X2(g)+3Y2(g)=2XY3(l) ΔH =2(abc) kJ/mol
B.X2(g)+3Y2(g)=2XY3(g) ΔH =2(ba) kJ/mol
C.X2(g)+3Y2(g)=2XY3(l) ΔH =(b+ca) kJ/mol
D.X2(g)+3Y2(g)=2XY3(g) ΔH =(a+b) kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com