(2011?太原二模)甲、乙两上实验小组分别进行测定Na
2CO
3和NaC1混合物中Na
2CO
3含量的实验.
甲组:沉淀分析法(相对分子质量:Na
2CO
3为106; BaCO
3为197; BaCl
2为208)
(1)配制一定物质的量浓度的BaC1
2溶液:用已经称量好的
20.8
20.8
gBaC1
2固体配制0.4mol?L
-lBaCl
2溶液250mL,所需要的仪器为量筒和
烧杯、玻璃棒、250ml容量瓶、胶头滴管
烧杯、玻璃棒、250ml容量瓶、胶头滴管
.
(2)把m g混合物溶解后加入过量BaC1
2溶液,然后将所得沉淀过滤、洗涤、烘干、称量,固体质量为wg,根据沉淀质量计算原混合物中Na
2CO
3的质分数为
(用含m、w的代数式表示).如果原溶液中过量的Ba
2+浓度达到0.01mol/L,则溶液中残留的CO
32-的物质的量浓度是
2.58×10-7mol/L
2.58×10-7mol/L
.[Ksp(BaCO
3)=2.58×10
-9]
乙组:气体分析法
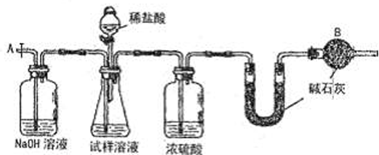
(3)实验中待锥形瓶中不再产生气体后,打开活塞从导管A端缓缓鼓入一定量的空气,这样做的目的是
使产生的二氧化碳全部进入后续的装置
使产生的二氧化碳全部进入后续的装置
.
(4)装置中干燥管B的作用是
吸收空气中的二氧化碳和水
吸收空气中的二氧化碳和水
.
(5)除已理的agNa
2CO
3样品外,实验中还应测定的数据是
U型管
U型管
处(填图中仪器的名称)装置实验前后的质量差.
(6)该实验还存在的明显缺陷是
盐酸具有挥发性,制得的二氧化碳中混有氯化氢,U型管增重的质量偏大,最后结果偏大.
盐酸具有挥发性,制得的二氧化碳中混有氯化氢,U型管增重的质量偏大,最后结果偏大.
.



