
���� ��1����ˮϡ�ʹٽ�������룬�������������̶�С����Һ�������̶ȣ�������Һ��c��H+����c��CH3COOH����c��CH3COO-������С�����¶Ȳ��䣬ˮ�����ӻ��������䣻
��2����ˮϡ�ʹٽ�������룬������м�����ͬ�����ӣ������ƴ�����룻
��3��������������ʡ�HCl��ǿ����ʣ�����pH��ͬ�Ĵ�������ᣬ����Ũ�ȴ������ᣬ��ˮϡ����ͬ�ı�������ˮϡ�����д������������Ӷ�����ϡ�ͺ������Һ��������Ũ�ȴ������
��4��pH��ͬ�Ĵ���Ũ�ȴ������ᣬȡ�������pH�Ĵ�������ᣬn��CH3COOH����n��HCl�����ֱ��õ�Ũ�ȵ�NaOH��Һ�кͣ�������ʵ���������ĵļ�࣮
��� �⣺��1��A����ˮϡ�ʹٽ�������룬�������������̶�С����Һ�������̶ȣ�������Һ��c��H+����c��CH3COOH����c��CH3COO-������С����A��ȷ��
B����ˮϡ�ʹٽ�������룬����Һ��n��H+������n��CH3COOH����С������c��H+��/c��CH3COOH������B����
C���¶Ȳ��䣬ˮ�����ӻ��������䣬����c��H+��•c��OH-�����䣬��C����
D��ˮ�����ӻ��������䣬������Ũ�ȼ�С������������Ũ����������c��OH-��/c��H+������D����
��ѡA��
��2����ˮϡ�ʹٽ�������룬ƽ�������ƶ���������м�����ͬ�����ӣ������ƴ�����룬ƽ�������ƶ���������Һ��c��H+��/c��CH3COOH���ı�ֵ����С���ʴ�Ϊ�����ң���С��
��3��������������ʡ�HCl��ǿ����ʣ�����pH��ͬ�Ĵ�������ᣬ����Ũ�ȴ������ᣬ��ˮϡ����ͬ�ı�������ˮϡ�����д������������Ӷ�����ϡ�ͺ������Һ��������Ũ�ȴ������ᣬ����pH�ף��ң��ʴ�Ϊ������
��4��pH��ͬ�Ĵ���Ũ�ȴ������ᣬȡ�������pH�Ĵ�������ᣬn��CH3COOH����n��HCl�����ֱ��õ�Ũ�ȵ�NaOH��Һ�кͣ�������ʵ���������ĵļ�࣬������������������Һ����ף��ң��ʴ�Ϊ������
���� ���⿼��������ʵĵ��뼰�������Һ�����жϣ�Ϊ��Ƶ���㣬��ȷ������ʵ�ƽ���ص��ǽⱾ��ؼ���ע�⣺��ˮϡ��ϡ��������У�����c��OH-��������������Ũ�ȶ���С��Ϊ�״��㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������и߶���9�µ��л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��������������ѧ��FulvioCacace���˻���˼��������о������N4���ӡ�N4���ӽṹ��ͼ��ʾ����֪����1mol N��N����167 kJ����������1mol N��N�ų�942 kJ������������Ϣ�����ݣ�����˵����ȷ���ǣ� ��
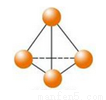
A��N4��N2��Ϊͬ���칹��
B��1mo1N4����ת��ΪN2������882 kJ����
C��N4��g���T 2N2��g�� ��H = - 882KJ
D��P4�����ף��ķ��ӽṹ��N4���ƣ�1mol N4��1mol P4������6mol�Ǽ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ����Уʵ���һ�ѧ�Լ�Ũ�����ǩ�ϵIJ������ݣ�����Ҫ480mL 1mol•L-1��ϡ���ᣮ�ø�Ũ���������ˮ���ƣ��ɹ�ѡ�õ������У��ٽ�ͷ�ιܣ��ڲ����������ձ�������Ͳ��
��ͼ����Уʵ���һ�ѧ�Լ�Ũ�����ǩ�ϵIJ������ݣ�����Ҫ480mL 1mol•L-1��ϡ���ᣮ�ø�Ũ���������ˮ���ƣ��ɹ�ѡ�õ������У��ٽ�ͷ�ιܣ��ڲ����������ձ�������Ͳ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ͭ��ʹп��ϡ����ķ�Ӧ���ʼӿ죬˵��Cu2+���д����� | |
| B�� | ����HA��HB�ĵ��볣������Դ�С����ֱ���ж�������Һ������ǿ�� | |
| C�� | ������2S2O��g���T3S��s��+SO2��g�����Է����У����ƶϸ÷�ӦΪ���ȷ�Ӧ | |
| D�� | ��Ũ�����Ũ�����Ϻ�����������Ƭ����Ƭ���ۻ���Ч��һ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ڢۢ� | C�� | �٢� | D�� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.01 mol•L-1HA����Һ��c��H+��=1��10-4mol•L-1 | |
| B�� | pH=3��HA��Һ��pH=11��NaOH��Һ�������Ϻ�������Һ��c��Na+����c��A-����c��OH-����c��H+�� | |
| C�� | Ũ�Ⱦ�Ϊ0.1 mol•L-1��HA��Һ��NaA��Һ�������Ϻ�������Һ�����ԣ��� c��OH-��-c��H+����c��HA��-c��A-�� | |
| D�� | pH=3��HA��Һ��pH=11��NaOH��Һ�������1��10��Ϻ�������Һ�� c��OH-��+c��A-���Tc��H+��+c��Na+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 CH3COOHΪ���������ᣬ�ڹ�ҵ�������������й㷺��Ӧ�ã�
CH3COOHΪ���������ᣬ�ڹ�ҵ�������������й㷺��Ӧ�ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ͬ�¶��£��������Ȼ�������ֱ������ͬ����Ģ�����ˮ ��0.1 mol/L�����0.1 mol/L�Ȼ�þ��Һ ��0.1 mol/L��������Һ�У�Ag+Ũ�ȣ��٣���=�ڣ��� | |
| B�� | �ں���BaSO4��������Һ�м���Na2SO4���壬c��Ba2+������ | |
| C�� | ��Mg��OH��2����Һ�еμ�FeCl3��Һ��������Ϊ���ɫ��˵���ܽ��Mg��OH��2��Fe��OH��3 | |
| D�� | ��֪I3-?I2+I-����ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
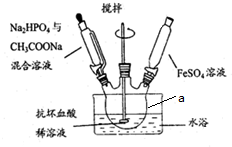
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com