
【题目】甲醇燃料分为甲醇汽油和甲醇柴油,工业合成甲醇的方法很多。
(1)一定条件下发生反应:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1
2CO(g)+O2(g)═2CO2(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则CO(g)+2H2(g)CH3OH(g)的△H═ _________.
(2)在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图1所示,该反应的△H____0 (填>、<或=).
(3)若要提高甲醇的产率,可采取的措施有(填字母)___________
A.缩小容器体积
B.降低温度
C.升高温度
D.使用合适的催化剂
E.将甲醇从混合体系中分离出来

(4)CH4和H2O在催化剂表面发生反应CH4+H2OCO+3H2,T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50%,计算该温度下上述反应的化学平衡常数_____________________(结果保留小数点后两位数字)
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图2是目前研究较多的一类固体氧化物燃料电池工作原理示意图,B极的电极反应式为_________
(6)25℃时,草酸钙的Ksp=4.0×10﹣8,碳酸钙的Ksp=2.5×10﹣9。向10ml碳酸钙的饱和溶液中逐滴加入8.0×10﹣4molL﹣1的草酸钾溶液10ml,能否产生沉淀__________(填“能”或“否”).
【答案】(1)△H=△H1+![]() △H2 ﹣
△H2 ﹣![]() △H3
△H3
(2)<
(3)A B E
(4)6.75
(5)CH3OH+3O2﹣﹣6e﹣=CO2+2H2O
(6)否
【解析】
试题分析:(1)①CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H1 ,②2CO(g)+O2(g)=2CO2(g)△H2,③2H2(g)+O2(g)=2H2O(g)△H3,据盖斯定律,①+![]() ×②﹣
×②﹣![]() ×③得CO(g)+2H2(g)CH3OH(g)的△H=△H1+
×③得CO(g)+2H2(g)CH3OH(g)的△H=△H1+![]() △H2 ﹣
△H2 ﹣![]() △H3。
△H3。
(2)在300℃到500℃时,CH3OH的物质的量减小,说明平衡逆向移动,逆反应是吸热反应,则该反应的正反应是放热反应,即△H<0.
(3)A.缩小容器体积,增大压强,平衡正向移动,甲醇的产率增加,正确;B.降低温度,平衡正向移动,甲醇的产率增加,正确;C.升高温度,平衡逆向移动,甲醇的产率减少,错误;D.使用合适的催化剂,平衡不移动,错误;E.将甲醇从混合体系中分离出来,有利平衡正向移动,提高甲醇的产量,正确;答案选ABE。
(4)CH4和H2O在催化剂表面发生反应CH4+H2OCO+3H2,T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50%,
CH4 + H2O CO + 3H2
起始物质的量浓度(molL﹣1) 1.0 1.0 0 0
转化物质的量浓度(molL﹣1) 0.5 0.5 0.5 1.5
平衡物质的量浓度(molL﹣1 0.5 0.5 0.5 1.5
K=![]() =
=![]() =6.75mol2/L2;
=6.75mol2/L2;
(5)根据原电池原理,负极上甲醇失电子生成二氧化碳,电极反应为:CH3OH+3O2﹣﹣6e﹣=CO2+2H2O
(6)碳酸钙溶液中钙离子浓度=![]() mol/L=5×10﹣5mol/L,二者混合后,钙离子浓度=2.5×10﹣5mol/L,草酸钾浓度为4.0×10﹣4mol/L,混合后c(Ca2+)c(C2O42﹣)=2.5×10﹣5 ×4.0×10﹣4=1×10﹣8<Ksp(4.0×10﹣8),所以无沉淀。
mol/L=5×10﹣5mol/L,二者混合后,钙离子浓度=2.5×10﹣5mol/L,草酸钾浓度为4.0×10﹣4mol/L,混合后c(Ca2+)c(C2O42﹣)=2.5×10﹣5 ×4.0×10﹣4=1×10﹣8<Ksp(4.0×10﹣8),所以无沉淀。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
A | 基态原子最外层电子数是次外层的三倍 |
B | 基态原子核外有13种不同运动状态的电子 |
C | 与B同一周期,原子中未成对电子数是同周期中最多 |
D | D2-的核外电子排布与氩原子相同 |
E | 是ds区原子序数最小的元素 |
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:____________(用相应的元素符号表示).A、D两种元素中,电负性A____________D (填“>”或“<”)
(2)A3分子的空间构型为____________,与其互为等电子体的分子为____________;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:____________,C7H15OH 中采用sp3杂化的原子共有____________个;
(4)E(NH3)42+配离子中存在的化学键类型有____________(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时。能得到两种不同结构的产物,则 E(NH3)42+的空间构型为____________(填序号)。
a.平面正方形b.正四面体 c.三角锥形 d.V形
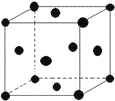
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3(1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式____________(用M、r、ρ表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
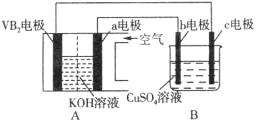
A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+
B.外电路中电子由c电极流向VB2电极
C.电解过程中,c电极表面先有红色物质析出,后有气泡产生
D.若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,水的离子常数KW=10—13,将此温度下pH=11的Ba(OH)2溶液aL与pH=1的H2SO4溶液bL混合,设混合溶液体积为两者之和,所得固体体积忽略不计。
(1)若所得混合溶液为中性,则a:b=________,生成沉淀物质的量为______mol(用含b表达式来表示)。
(2)若a:b=9:2,则所得溶液pH=_____。该混合溶液最多能溶解铁粉_______g(用含a、b表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图a、b、c.d均为石墨电极,通电进行电解。下列说法正确的是
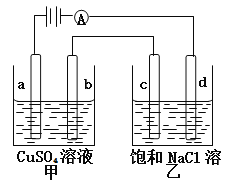
A.甲中a的电极反应为:4OH--4e-=O2↑+2H2O
B.电解时向乙中滴入酚酞试剂,c电极附近先变红。
C.当d电极产生2g气体时,b极有32g物质析出。
D.电解少量时间后向乙中加适量盐酸,溶液组成可以恢复到原电解前的状态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:①2NO+Na2O2=2NaNO2 ②2NO2+Na2O2=2NaNO3③酸性KMnO4溶液可将NO2﹣氧化为NO3﹣,MnO4﹣还原成Mn2+。
Ⅰ.产品制备与检验:用如图1装置制备NaNO2:
(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移的方向和数目__________
(2)B装置的作用是_______
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有硝酸钠、碳酸钠、氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在右框内画出增加的装置图2,并标明盛放的试剂.
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论)_____________________
Ⅱ.含量的测定
称取装置C中反应后的固体4.00g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
![]()
(5)第一组实验数据出现异常,造成这种异常的原因可能是________(双项选择)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定结束仰视读数
D.滴定结束俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数________(结果保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,如合成的金刚烷胺就是一种抗病毒药剂,对帕金森症有良好的疗效。由环戊二烯合成金刚烷的路线如下:
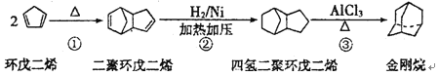
请回答下列问题:
(1)金刚烷的分子式为_______________________。
(2)反应①的反应类型是______________________。
(3)金刚烷与四氢二聚环戊二烯的关系是_____________(填字母)。
a.互为同系物 b.互为同分异构体 c.均为烷烃 d.均为环烃
(4)下面是以环戊烷为原料制备环戊二烯的合成路线:
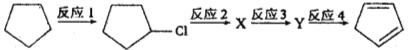
其中, X的名称是______________;
(5)反应4的化学方程式是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学与技术)聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:

(1)搅拌加热操作过程中发生反应的离子方程式 ;
(2)生产过程中操作B和D的名称均为 (B和D为简单操作)。
(3)反应中副产品a是 (用化学式表示)。
(4)生产过程中可循环使用的物质是 (用化学式表示)。
(5)调节pH至4.0~4.5的目的是 。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C物质可选用 。
A.NaOH | B.Al | C.氨水 | D.Al2O3E.NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,在等体积的 ① pH=0的H2SO4溶液、② 0.05 mol/L的Ba (OH)2溶液、③ pH=10的Na2S溶液、④ pH=5的NH4NO3溶液中,发生电离的水的物质的量之比 。
(2)常温下,0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后:
c(CH3COO) + c(CH3COOH)= mol/L
c(H+) c(CH3COO) - c(CH3COOH) +2c(OH) (填“>”、“<”或“=”)
(3)常温下,把pH=11的氢氧化钠溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系是 。
(4)常温下,把pH=2的H2SO4和pH=11的NaOH溶液混和,混和液pH=7。则两溶液的体积比是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com