
| A、化合物KCrO2中元素为+3价 |
| B、实验①证明Cr2O3是两性氧化物 |
| C、实验②证明氧化性:Cr2O72->I2 |
| D、实验③证明H2O2既有氧化性又有还原性 |


 智趣暑假温故知新系列答案
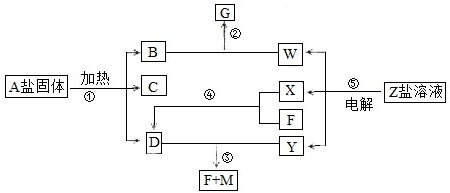
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol过氧化钠固体中含阴离子个数为0.2NA |
| B、1mol金刚石中含C-C的数目为4NA |
| C、标准状况下,22.4L乙炔中含π键数为2NA |
| D、1molNaHSO4晶体中阳离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠溶液中:K+、SO42-、Cl-、H+ |
| B、使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- |
| C、使酚酞试液呈红色的溶液中:Mg2+、Cu2+、SO42-、K+ |
| D、c(H+)=10-14mol/L的溶液中:Na+、AlO2-、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 硼化钒-空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时的反应为:4VB2+11O2═4B2O3+2V2O5,下列说法正确的是( )
硼化钒-空气电池是目前储电能力最高的电池,电池示意图如图所示,该电池工作时的反应为:4VB2+11O2═4B2O3+2V2O5,下列说法正确的是( )| A、电极a是电源负极 |
| B、溶液中的OH向a极移动 |
| C、电子由VB2极经KOH溶液流向电极a |
| D、VB2极发生的电极反应为:2VB2+22OH-═V2O5+2B2O3+11H2O+22e- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(N2):v(H2):v(NH3)=1:3:2 |
| B、c(N2):c(H2):c(NH3)=1:3:2 |
| C、容器内混合气体的平均相对分子质量不变 |
| D、单位时间里每增加1molN2,同时增加3molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-87.4kJ?mol-1.300℃时,在一定容积的密闭容器中,当c(CO2)=1.00kJ?mol-1、c(H2)=1.60kJ?mol-1开始反应,结果如图所示,回答下列问题:
I.已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-87.4kJ?mol-1.300℃时,在一定容积的密闭容器中,当c(CO2)=1.00kJ?mol-1、c(H2)=1.60kJ?mol-1开始反应,结果如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com