
ĻĀĮŠÓŠ¹ŲŃÕÉ«±ä»Æ“ķĪóµÄŹĒ£Ø £©
A£®ŌŚ4mL0.1mol/LµÄK2Cr2O7ČÜŅŗÖŠµĪ¼ÓŹżµĪ1mol/LNaOHČÜŅŗ£¬ČÜŅŗŃÕÉ«“Ó³ČÉ«±ä³É»ĘÉ«
B£®ŌŚŹŌ¹ÜÖŠ¼ÓČėÉŁĮæĀČ»Æīܾ§Ģ壬µĪ¼ÓÅØŃĪĖįČܽāŗó¼ÓĖ®Ļ”ŹĶÖĮ×ĻÉ«£¬½«ŹŌ¹ÜÖĆÓŚČČĖ®ÖŠĘ¬æĢ£¬ČÜŅŗŃÕÉ«±ä³É·ŪŗģÉ«
C£®ĻņŃŖŗģÉ«µÄFe£ØSCN£©3ČÜŅŗÖŠ¼ÓČėÉŁĮæKI¹ĢĢ壬ČÜŅŗŃÕÉ«±äĒ³
D£®ÓĆ50mLÕėĶ²³éČ”30mLŗģ×ŲÉ«µÄNO2ĘųĢå²¢·ā×”×¢Éäæ×£¬µ±ÓĆĮ¦ĶĘŃ¹»īČū£¬Ń¹ĖõÕėĶ²ÖŠµÄĘųĢå£Ø“Ė¹ż³ĢÖŠ²»æ¼ĀĒĪĀ¶Č±ä»Æ£©£¬“ÓÕėĶ²¶„¶Ė¹Ū²ģ£¬ĘųĢåŃÕÉ«Öš½„±äĒ³
 µ¼Ń§Č«³ĢĮ·““ÓÅѵĮ·ĻµĮŠ“š°ø
µ¼Ń§Č«³ĢĮ·““ÓÅѵĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijŅ»ŌŖČõĖįHAµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖM”£ŌŚt”ꏱ£¬½«a gHAĶźČ«ČܽāÓŚĖ®£¬µĆVmL±„ŗĶČÜŅŗ£¬²āµĆøĆČÜŅŗµÄĆܶČĪŖ¦Ńg·cm£3£¬ĘäÖŠn(A£)ĪŖbmol”£ĻĀĮŠŠšŹö£¬“ķĪóµÄŹĒ
A£®ČÜŅŗÖŠc(H+) =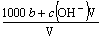 B£®ĪļÖŹµÄĮæÅضČc(HA) =
B£®ĪļÖŹµÄĮæÅضČc(HA) =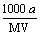 mol·L£1
mol·L£1
C£®t”ꏱ£¬HAµÄČܽā¶ČS =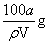 D£®HAµÄÖŹĮæ·ÖŹżw(HA) =
D£®HAµÄÖŹĮæ·ÖŹżw(HA) =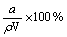
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
½šŹōÄĘÓėĖ®µÄ·“Ó¦ŹĒ֊ѧ»Æѧ֊µÄŅ»øöÖŲŅŖ·“Ó¦”£½Ģ²ÄÖŠøĆŹµŃéŌų³öĻÖ¹ż¼øÖÖ²»Ķ¬µÄŃŻŹ¾·½·Ø£¬·Ö±šČēĻĀĶ¼ÖŠ¼×”¢ŅŅ”¢±ūĖłŹ¾£ŗ
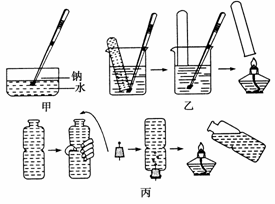
(1)ĻÖ°“Ķ¼¼×ĖłŹ¾µÄ·½·Ø£¬ŌŚŹŅĪĀŹ±£¬ĻņŹ¢ÓŠ±„ŗĶCa(OH)2ČÜŅŗµÄĖ®²ŪÖŠ£¬¼ÓČėŅ»Š”æ齚ŹōÄĘ”£ĻĀĮŠĻÖĻóĆčŹöÕżČ·µÄŹĒ________(Ģī×ÖÄø)”£
A£®ÄĘø”ŌŚŅŗĆęÉĻ£¬²¢ĖÄ“¦ÓĪ¶Æ£¬×īŗóĻūŹ§
B£®ÄĘČŪ»Æ³ÉŅ»øö¹āĮĮµÄŠ”Ēņ
C£®ČÜŅŗµ×²æÓŠŅų°×É«ĪļÖŹÉś³É
D£®»Öø“µ½ŹŅĪĀŹ±£¬Ė®²Ūµ×²æÓŠ¹ĢĢåĪļÖŹĪö³ö
(2)Ēė²¹³ä²¢Ķź³É¼×ŹµŃéÖŠ“ÓŹŌ¼ĮĘæÖŠČ”³öÄʵ½ĻņĖ®²ŪÖŠĶ¶ČėÄʵÄÓŠ¹Ų²Ł×÷£ŗÓĆÄ÷×Ó“ÓŹŌ¼ĮĘæÖŠČ”³öŅ»Š”æéÄĘ”ś________________________________”śÓĆÄ÷×Ó¼ŠČ”ĒŠŗĆµÄ½šŹōÄĘĶ¶Čėµ½Ź¢ÓŠCa(OH)2ČÜŅŗµÄĖ®²ŪÖŠ”£
(3)ijĶ¬Ń§ÓĆÄ÷×Ó¼Š×”Ņ»æéÄĘ£¬°“Ķ¼ŅŅĖłŹ¾·½·ØĄ“ŹÕ¼Æ²śÉśµÄĘųĢ壬µ«ÄĘŗÜæģĶŃĀ䣬ŹµŃéƻӊ³É¹¦”£ÕżČ·µÄ²Ł×÷Ó¦ĪŖ________________________________________________”£
(4)ÓĆ×°ĀśĖ®µÄæóČŖĖ®Ęæ°“Ķ¼±ū·½·Ø½ųŠŠŹµŃ锣ÓĆŹÖ¼·Ń¹æóČŖĖ®Ęæ²¢Čū½ō“ųÓŠÄʵÄČū×Ó”£¹²ÅųöĖ®µÄĢå»żĪŖ16.8 mL£¬“żÄĘ·“Ó¦½įŹųŗó£¬øɱńµÄ“ųČūæóČŖĖ®Ęæ»Öø“³ÉŌד£¬¼ŁÉčĘæÄŚ”¢ĘæĶā¾łŹōÓŚ±ź×¼×“æö£¬ŌņĖłÓƵÄÄʵÄÖŹĮæĪŖ________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
°“ÕÕ°¢·ü¼ÓµĀĀŽ¶ØĀÉ£¬ĻĀĮŠŠšŹö²»ÕżČ·µÄ£Ø £©
A£®Ķ¬ĪĀĶ¬Ń¹ĻĀĮ½ÖÖĘųĢåµÄĢå»żÖ®±ČµČÓŚĪļÖŹµÄĮæÖ®±Č
B£®Ķ¬ĪĀĶ¬Ń¹ĻĀĮ½ÖÖĘųĢåµÄĪļÖŹµÄĮæÖ®±ČµČÓŚĆܶČÖ®±Č
C£®Ķ¬ĪĀĶ¬Ń¹ĻĀĮ½ÖÖĘųĢåµÄĆܶČÖ®±ČµČӌĦ¶ūÖŹĮæÖ®±Č
D£®Ķ¬ĪĀĶ¬Ģå»żĻĀĮ½ÖÖĘųĢåµÄĪļÖŹµÄĮæÖ®±ČµČÓŚŃ¹ĒæÖ®±Č
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÓĆCH4“߻ƻ¹ŌNOxæÉŅŌĻū³żµŖŃõ»ÆŗĻĪļµÄĪŪČ¾”£ĄżČē£ŗ
¢ŁCH4£Øg£©+4NO2£Øg£©=4NO£Øg£©+CO2£Øg£©+2H2O£Øg£©£»”÷H=£574kJ/mol
¢ŚCH4£Øg£©+4NO£Øg£©=2N2£Øg£©+CO2£Øg£©+2H2O£Øg£©£»”÷H=£1160kJ/mol
ĻĀĮŠĖµ·ØÖŠ“ķĪóµÄŹĒ£Ø £©
A£®µČĪļÖŹµÄĮæµÄCH4ŌŚ·“Ó¦¢Ł”¢¢ŚÖŠ×ŖŅʵē×ÓŹżĻąĶ¬
B£®ÓÉ·“Ó¦¢ŁæÉĶĘÖŖ£ŗCH4£Øg£©+4NO2£Øg£©=4NO£Øg£©+CO2£Øg£©+2H2O£Øl£©£»”÷H>£574kJ/mol
C£®4NO2£Øg£©+2N2£Øg£©=8NO£Øg£©£»”÷H=+586kJ/mol
D£®ČōÓƱź×¼×“æöĻĀ4.48L CH4°ŃNO2»¹ŌĪŖN2£¬Õūøö¹ż³ĢÖŠ×ŖŅʵĵē×Ó×ÜŹżĪŖ1.6NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚ¼×”¢ŅŅ”¢±ūČżøö²»Ķ¬ĆܱÕČŻĘ÷ÖŠ°“²»Ķ¬·½Ź½Ķ¶ĮĻ£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ØĘšŹ¼ĪĀ¶ČŗĶĘšŹ¼Ģå»żĻąĶ¬£©£ŗN2£Øg£©+3H2£Øg£© 2NH3£Øg£©””¦¤H<0£¬Ļą¹ŲŹż¾ŻČēĻĀ±ķĖłŹ¾£ŗ
2NH3£Øg£©””¦¤H<0£¬Ļą¹ŲŹż¾ŻČēĻĀ±ķĖłŹ¾£ŗ
| ČŻĘ÷ | ¼× | ŅŅ | ±ū |
| Ļą¹ŲĢõ¼ž | ŗćĪĀŗćČŻ | ¾ųČČŗćČŻ | ŗćĪĀŗćŃ¹ |
| ·“Ó¦ĪļĶ¶ĮĻ | 1mol N2”¢3mol H2 | 2mol NH3 | 2mol NH3 |
| Ę½ŗāŹ±ČŻĘ÷Ģå»ż | V¼× | VŅŅ | V±ū |
| ·“Ó¦µÄĘ½ŗā³£ŹżK= | K¼× | KŅŅ | K±ū |
| Ę½ŗāŹ±NH3µÄÅضČ/mol·L-1 | c¼× | cŅŅ | c±ū |
| Ę½ŗāŹ±NH3µÄ·“Ó¦ĖŁĀŹ/mol·L-1·min-1 | v¼× | vŅŅ | v±ū |
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A£®V¼×>V±ū B£®KŅŅ<K±ū C£®cŅŅ>c¼× D£®v¼×=v±ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ»Æѧ·“Ó¦ŌŚŅ±½š¹¤ŅµÖŠĆ»ÓŠµĆµ½¹ć·ŗÓ¦ÓƵďĒ(””””)
A.MgCl2(ČŪČŚ) Mg+Cl2”ü
Mg+Cl2ӟ
B.Al2O3+3C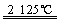 2Al+3COӟ
2Al+3COӟ
C.Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
D.HgS+O2 Hg+SO2
Hg+SO2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Šæ—æÕĘųµē³ŲæÉÄܳÉĪŖĪ“Ą“µÄĄķĻė¶ÆĮ¦Ō“£¬øƵē³ŲµÄµē½āÖŹČÜŅŗæÉŅŌŹĒĖįŠŌ»ņ¼īŠŌ”£ŌŚ¼īŠŌČÜŅŗÖŠøƵē³Ų×Ü·“Ó¦æɱķŹ¾ĪŖ£ŗ2Zn£«4NaOH£«O2===2Na2ZnO2 £«2H2O”£ĻĀĮŠÓŠ¹ŲŠæ£æÕĘųµē³ŲĖµ·ØÕżČ·µÄŹĒ
A£®¼īŠŌµē½āÖŹČÜŅŗÖŠÕż¼«·“Ó¦Ź½ĪŖ£ŗ4OH£- 4e£=== O2”ü£«2H2O
B£®¼īŠŌ»ņĖįŠŌµē½āÖŹČÜŅŗÖŠ£¬øƵē³ŲÕż¼«·“Ó¦Ź½ĻąĶ¬
C£®øƵē³Ų¹¤×÷Ź±£¬Na£«ŅĘĻņøŗ¼«
D£®ĆæÉś³É1 mol ZnO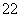 ×ŖŅʵē×ÓŹżĪŖ2NA
×ŖŅʵē×ÓŹżĪŖ2NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠÓŠ¹ŲŹµŃé²Ł×÷µÄĖµ·Ø“ķĪóµÄŹĒ(””””)
A£®ÖŠŗĶµĪ¶ØŹ±Ź¢“ż²āŅŗµÄ׶ŠĪĘæÖŠÓŠÉŁĮæĖ®¶ŌµĪ¶Ø½į¹ūĪŽÓ°Ļģ
B£®ŌŚĖį¼īÖŠŗĶµĪ¶ØŹµŃéÖŠ£¬µĪ¶Ø¹Ü¶¼ŠčČóĻ“£¬·ńŌņŅżĘšĪó²ī
C£®µĪ¶ØŹ±£¬×óŹÖæŲÖʵĪ¶Ø¹Ü»īČū£¬ÓŅŹÖĪÕ³Ö׶ŠĪĘ棬±ßµĪ±ßÕńµ“£¬ŃŪ¾¦×¢ŹÓµĪ¶Ø¹ÜÖŠµÄŅŗĆę
D£®³ĘĮæŹ±£¬³ĘĮæĪļ·ÅŌŚ³ĘĮæÖ½ÉĻ£¬ÖĆÓŚĶŠÅĢĢģĘ½µÄ×óÅĢ£¬ķĄĀė·ÅŌŚĶŠÅĢĢģĘ½µÄÓŅÅĢ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com