

| A. | M极是电解池的阴极 | |
| B. | 溶液中的阴离子向N极移动 | |
| C. | M极上放出的气体能使湿润的淀粉碘化钾试纸变蓝 | |
| D. | 在M、N两极流过0.4mole-时,N极上会增重6.4g氯化铜溶液 |
分析 用石墨作电极电解氯化铜溶液,连接电源正极的为电解池的阳极,发生氧化反应:2Cl--2e-=Cl2↑,连接电源负极的为电解池的阴极,发生:Cu2++2e-=Cu,电解池工作时,阴离子向阳极移动,阳离子向阴极移动,以此解答该题.
解答 解:A.M极连接电源的正极,为电解池的阳极,故A错误;
B.阴离子向阳极移动,即向M极移动,故B错误;
C.M极上发生氧化反应:2Cl--2e-=Cl2↑,生成的氯气具有氧化性,可氧化碘化钾生成碘单质,试纸变蓝,故C正确;
D.在M、N两极流过0.4mol e-时,N极发生:Cu2++2e-=Cu,析出0.2mol铜,即12.8g,故D错误.
故选C.
点评 本题考查电解池知识,为高频考点,侧重考查学生的分析能力和计算能力,题目难度不大,注意把握电极的判断以及电极方程式的书写,为解答该题的关键.


科目:高中化学 来源: 题型:选择题
| A. | H+、Ca2+、CI-、CO32- | B. | K+、Na+、OH-、CI- | ||
| C. | Na+、Mg2+、SO42-、OH- | D. | Cu2+、Ba2+、CI-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 苯乙醇属于芳香醇,它与邻甲基苯酚互为同系物 | |
| B. | 1 mol CPAE最多可与含4 mol Br2的水溶液发生反应 | |
| C. | 用FeCl3溶液可以检测上述反应中是否有CPAE生成 | |
| D. | 咖啡酸、苯乙醇及CPAE都能发生取代、加成和消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =O+RMgX→
=O+RMgX→ $\stackrel{H_{2}O}{→}$
$\stackrel{H_{2}O}{→}$ 现以乙烯和必要的无机物为原料合成2-丁醇,进而合成一种分子式为C6H8O4的具有六元环的物质J,合成线路如图,G中有两种不同化学环境的氢原子.
现以乙烯和必要的无机物为原料合成2-丁醇,进而合成一种分子式为C6H8O4的具有六元环的物质J,合成线路如图,G中有两种不同化学环境的氢原子.
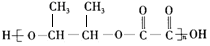 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com