
| �� | �� | �� | �� |
| 0.1mol/L NaOH��Һ | pH=11 NaOH��Һ | 0.1mol/L CH3COOH��Һ | pH=3 CH3COOH��Һ |
 H++OH�������ƣ���ǰ��ʹˮ�ĵ���ƽ�����Ƶij̶ȴ��ں��ߣ�����ˮ�������������Ũ�ȸ�С����A��ȷ������ϡ�Ͷ��ɣ�c1?V1=c2?V2�����ϡ�͵�ԭ����100�������Ũ�ȱ�Ϊ0.001mol/L�����Ǵ��������ᣬ��ʹϡ��100��Һ������ȫ���룬����Һ��������Ũ��С��0.001mol/L������pH=��lgc(H+)������ҺpH>3�������������ͬ����B����������۵������ϣ�����n=c?V��֪��NaOH��CH3COOHǡ����ȫ�кͣ��õ���CH3COONa��ǿ�������Σ���Ϻ���Һ�������ԣ�pH>7������Һ��pH=7�������һ�����������V(NaOH)<V(CH3COOH)����C��������Һ��������ƽ�⣺CH3COOH
H++OH�������ƣ���ǰ��ʹˮ�ĵ���ƽ�����Ƶij̶ȴ��ں��ߣ�����ˮ�������������Ũ�ȸ�С����A��ȷ������ϡ�Ͷ��ɣ�c1?V1=c2?V2�����ϡ�͵�ԭ����100�������Ũ�ȱ�Ϊ0.001mol/L�����Ǵ��������ᣬ��ʹϡ��100��Һ������ȫ���룬����Һ��������Ũ��С��0.001mol/L������pH=��lgc(H+)������ҺpH>3�������������ͬ����B����������۵������ϣ�����n=c?V��֪��NaOH��CH3COOHǡ����ȫ�кͣ��õ���CH3COONa��ǿ�������Σ���Ϻ���Һ�������ԣ�pH>7������Һ��pH=7�������һ�����������V(NaOH)<V(CH3COOH)����C��������Һ��������ƽ�⣺CH3COOH H++CH3COO��������������Һ�е�������NaOH��Һ�����������ӵ�������ƽ�����ƣ����������кͷ�Ӧʱ������ԶԶ������NaOH���ز��㣬��������Һ�п��ܳ��֣�c(CH3COO��)>c(H+)>c(Na+)>c(OH��)����D��ȷ��
H++CH3COO��������������Һ�е�������NaOH��Һ�����������ӵ�������ƽ�����ƣ����������кͷ�Ӧʱ������ԶԶ������NaOH���ز��㣬��������Һ�п��ܳ��֣�c(CH3COO��)>c(H+)>c(Na+)>c(OH��)����D��ȷ��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�





 +NaHCO3��
+NaHCO3�� +CO2��+H2O
+CO2��+H2O +NaHCO3��
+NaHCO3�� +CO2��+H2O
+CO2��+H2O

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | A | B | C | D |
| ���� �ṹ ��Ϣ |
�����Ƴɵĸ�ѹ�ƣ������Ļƹ�����ǿ�����Զ�� | ��ҵ��ͨ������Һ̬��������䵥�ʣ�ԭ�ӵ������δ�ﵽ�ȶ��ṹ�� | ���ʳ��¡���ѹ�������壬ԭ�ӵ�L����һ��δ�ɶԵ�p���ӣ� | +2�������ӵĺ�������Ų�����ԭ����ͬ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
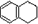 ������ʽ��C10H12��������Ϊ��ɫҺ�壬�д̼�����ζ���е�207�棬������ˮ����һ���������ܼ�������Һ�巢����Ӧ��C10H12+4Br2��C10H8Br4+4HBr�����ɵ����廯��������Ϊ��̬��������ˮ�����������⻯����Һ�塢����ˮ�ʹ�����Ϊԭ�ϣ��Ʊ�����������������Һ��ʵ�鲽�����£�
������ʽ��C10H12��������Ϊ��ɫҺ�壬�д̼�����ζ���е�207�棬������ˮ����һ���������ܼ�������Һ�巢����Ӧ��C10H12+4Br2��C10H8Br4+4HBr�����ɵ����廯��������Ϊ��̬��������ˮ�����������⻯����Һ�塢����ˮ�ʹ�����Ϊԭ�ϣ��Ʊ�����������������Һ��ʵ�鲽�����£�
| �� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com