
| A. |  | B. |  | C. |  | D. |  |
科目:高中化学 来源: 题型:选择题

| A. | ①最重 | B. | ②最重 | C. | ③最重 | D. | ①②③一样重 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 +
+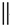 $\stackrel{△}{→}$
$\stackrel{△}{→}$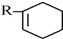
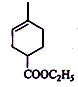 +Br2→
+Br2→ .
.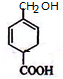 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 排水法收集气体后,先熄灭酒精灯,再取出导气管 | |
| B. | 蒸馏自来水时,冷凝水从上口进,从下口出 | |
| C. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| D. | 稀释浓硫酸时,应将浓硫酸慢慢加入水中并及时搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | ① | ② | ③ | ④ |
| m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
| A. | 实验①反应后溶液中含有Fe3+、Fe2+、Cu2+ | |
| B. | 实验②③反应后剩余固体全部是Cu | |
| C. | 实验④的滤液中c(Fe2+)=1.5 mol/L | |
| D. | 原粉末样品中m(Fe):m(Cu)=7:8 |
查看答案和解析>>
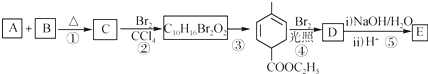
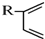
科目:高中化学 来源: 题型:推断题
 根据如图反应框图填空.已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.
根据如图反应框图填空.已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.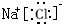
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L H2O中所含的原子总数为0.3NA | |
| B. | 0.1 molCl2与足量的NaOH稀溶液反应,转移的电子总数为0.2NA | |
| C. | 1mol•L一1的NaCl溶液中所含Na+数目为NA | |
| D. | 常温常压下,14g由N2和CO组成的混合气体中含有的原子总数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com