
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题

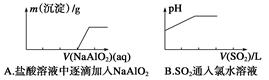
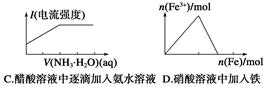
| 选项 | X | Y | Z | M |
| A | NH3 | NO | NO2 | O2 |
| B | Cl2 | FeCl3 | FeCl2 | Fe |
| C | Al | Al(OH)3 | NaAlO2 | NaOH |
| D | NaOH | Na2CO3 | NaHCO3 | CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
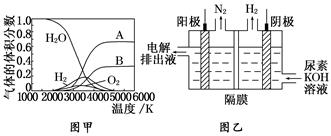
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.药皂中加入少量苯酚,可以起到杀菌消毒的作用 |
| B.明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| C.为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| D.NaHCO3受热能分解产生CO2气体,在食品工业中可作为焙制糕点的膨松剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
| B | NaCl | NaHCO3 | Na2CO3 | ②加热 |
| C | N2 | NO2 | HNO3 | ③加热 |
| D | C | CO | CO2 | ④灼热炭粉 |
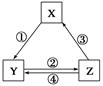
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| A | KNO3溶液 | KOH | 加入FeCl3溶液,并过滤 |
| B | FeCl3溶液 | FeCl2 | 加入稍过量双氧水后放置 |
| C | CO | O2 | 通过灼热的铜网后收集气体 |
| D | K2CO3固体 | NaHCO3 | 置于坩埚中加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.MgO、Al2O3可用于制作耐高温材料 |
| B.Si可用作太阳能电池材料 |
| C.工业上采用电解水法制氢气,解决能源短缺 |
| D.氢氧化铝用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com