
| A. | 活化分子的能量明显增加 | B. | 改变了化学反应的能量变化 | ||
| C. | 降低了反应的活化能 | D. | 增加了活化分子的百分数 |
科目:高中化学 来源: 题型:选择题
| A. | 溶液不分层,溶液呈紫红色 | B. | 溶液分两层,上层液体呈紫红色 | ||
| C. | 溶液分两层,下层液体呈紫红色 | D. | 溶液分两层,下层是无色液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水中加盐酸:2H++Ca(OH)2═Ca2++2H2O | |
| B. | 向NaHCO3溶液中加入NaOH溶液:HCO3-+OH-═CO32-+H2O | |
| C. | 氯气溶于水:Cl2+H2O?2H++ClO-+Cl- | |
| D. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | CO2 | C. | H2O2 | D. | NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量使用化肥农药,提高粮食产量 | |
| B. | 建设三峡大坝使用了大量水泥,水泥是硅酸盐材料 | |
| C. | 汽车安装尾气转化装置可以减少NO、CO等污染物的排放 | |
| D. | 开发新能源,减少对化石能源的依赖,也能减少对大气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(1)△H=-149.2 kJ/mol | B. | H2(g)+O2(g)═H2O(1)△H=+285.8 kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | D. | 2H2(g)+O2(g)═2H2O(1)△H=-571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6L三氧化硫中含有硫原子的数目为1.5NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 标准状况下,22.4L氯气与足量铁粉充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
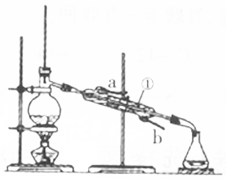 按要求填空:
按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散系中分散质粒子的大小:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| B. | FeCl3溶液和Fe(OH)3胶体都能透过滤纸 | |
| C. | 当一束强可见光通过Fe(OH)3胶体时会出现光亮的“通路” | |
| D. | 将饱和FeCl3溶液滴入NaOH溶液中可制得Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com