
分析 (1)氧化铜和氢气反应生成铜和氧化亚铜、水,所以固体减少的质量为氧元素的质量,根据剩余氧元素的质量计算氧化亚铜的物质的量,再根据元素守恒计算铜的物质的量;
(2)根据铜的物质的量计算铜的质量,从而得出氧化亚铜的质量,再根据反应方程式计算氧化亚铜生成铜的质量,两部分铜的质量即为固体的质量;
(3)采用极限法判断气体的成分,然后列方程式组求出一氧化氮和二氧化氮的物质的量之比.
解答 解:(1)n(CuO)=$\frac{8g}{80g/mol}$=0.1mol,氧元素的物质的量=n(CuO)═铜元素的物质的量=0.1mol,固体由CuO生成Cu和Cu2O,减少的质量为氧元素的质量,即8g-6.8g=1.2g,减少的氧元素的物质的量=$\frac{1.2g}{16g/mol}$=0.075mol,所以Cu2O中氧元素的物质的量=0.1mol-0.075mol=0.025mol,所以n(Cu2O)=0.025mol,根据铜元素守恒得n(Cu)=0.1mol-2×0.025mol=0.05mol,所以单质铜与氧化亚铜的物质的量之比是2:1,
故答案为:2:1;
(2)n(Cu)=0.1mol-2×0.025mol=0.05mol,所以m(Cu)=0.05mol×64g/mol=3.2g,
氧化亚铜的质量=6.8g-3.2g=3.6g,
氧化亚铜和稀硫酸反应,铜和稀硫酸不反应,设氧化亚铜和稀硫酸反应生成铜的质量为x,
氧化亚铜和稀硫酸反应的方程式为:
Cu2O+H2SO4=CuSO4+Cu+H2O
144g 64g
3.6g x
x=1.6g,所以可得到固体的质量=3.2g+1.6g=4.8g,
故答案为:4.8;
(3)①通过②分析知,6.8克的铜和氧化亚铜的混合物与硝酸反应相当于4.8克的铜与硝酸反应,
设铜与硝酸反应全部生成二氧化氮,二氧化氮的体积为:
Cu+4HNO3=Cu(NO3)2+2NO2 ↑+2H2O
64g 44.8L
4.8g 3.36L
设铜与硝酸反应全部生成一氧化氮,一氧化氮的体积为:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
192g 44.8L
4.8g 1.12L
1.12L<1.568<3.36L,所以该气体是二氧化氮和一氧化氮的混合物,
设生成一氧化氮的物质的量为ymol,生成二氧化氮的物质的量为zmol,
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
192g 2mol
96yg ymol
Cu+4HNO3=Cu(NO3)2+2NO2 ↑+2H2O
64g 2mol
32zg zmol
①(y+z)×22.4L/mol=1.568L
②96y+32z=4.8
解出y=0.04,z=0.03,所以一氧化氮和二氧化氮的物质的量之比为4:3,
故答案为:4:3.
点评 本题考查了铜的性质,计算量较大,注意运用分析、转化的思想解题,易错题是(2)题,容易把氧化铜生成的铜单质漏掉而造成错误解答.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
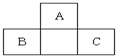 A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )
A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组元素是( )| A. | Be、Na、Al | B. | B、Mg、Si | C. | C、Al、P | D. | O、P、Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
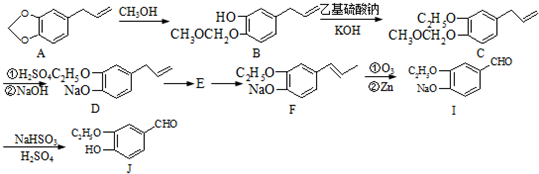
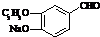 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$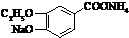 +2Ag↓+3NH3+H2O或
+2Ag↓+3NH3+H2O或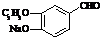 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$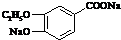 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.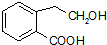 .
. 合成
合成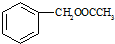 合成路线流程图示例如下:
合成路线流程图示例如下: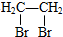
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸可用于雕刻玻璃,说明氢氟酸具有强酸性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸具有强氧化性 | |
| C. | 常温下浓硫酸可用铝罐贮存,说明铝与浓硫酸不反应 | |
| D. | 氨水可使酚酞试剂变为红色,说明氨水显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铸铁输油管道应埋在干燥致密不透气的土壤中 | |
| B. | 白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 | |
| C. | 钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-=4OH- | |
| D. | 在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com