
| A. | AgCl的溶解度增大 | B. | AgCl的溶解度、溶度积KSP均不变 | ||
| C. | AgCl的溶度积KSP增大 | D. | AgCl的溶解度、溶度积KSP均增大 |
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ②>③>①>④ | B. | ②>③>④>① | C. | ①>④>②>③ | D. | ①>③>④>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/% | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前2s的平均速率v(CO)=0.080mol/L/s | |
| B. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.11mol/L | |
| C. | T K时起始向容器中充入0.9molCOCl2/0.10molCO,反应达到平衡前v(正)>v(逆) | |
| D. | T K时起始向容器中充入1.0molCl2和0.9molCO.达到平衡时,Cl2的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
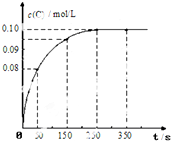 在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C) 随时间变化的曲线如图所示,下列说法不正确的是( )
在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C) 随时间变化的曲线如图所示,下列说法不正确的是( )| A. | 反应在0~50s的平均速率v(C)=1.6×10-3mol/(L•s) | |
| B. | 该温度下,反应的平衡常数K=0.025 | |
| C. | 保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的△H<0 | |
| D. | 反应达平衡后,再向容器中充入 1 mol A,该温度下再达到平衡时0.1mol/L<c(C)<0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 变化过程 | △H | △S |
| 4Fe(s)+3O2(g)=2Fe2O3(s) | <0 | |
| CaCO3(s)分解为CaO(s)和CO2(g) |
| 时间/min | A | B | C | D |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的摩尔质量是58.5g | |
| B. | 32g氧气中含有2mol氧 | |
| C. | 58.5gNaCl中含有l mol NaCl分子 | |
| D. | 0.l mol二氧化碳含有6.02×1022个CO2分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com