
【题目】某同学设计如图所示元素周期表,已知Z元素的最外层电子数是次外层的3倍。空格中均有对应的元素填充。以下说法正确的是
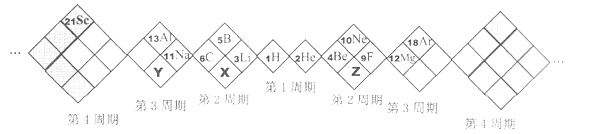
A. 白格中都是主族元素,灰格中都是副族元素
B. X和Z形成的化合物只有两种
C. X、Y元素最高价氧化物对应的水化合物酸性:X>Y
D. X、Y、Z的气态氢化物中最稳定的是X的氢化物
【答案】C
【解析】由学生设计的元素周期表,白色格为主族元素与零族元素,灰色格为副族元素,以H、He对称,左侧含有4个白色格的单元中,右格为IA族、上格为ⅢA族、左格为ⅣA族、下格为VA族,左侧含有4个白色格的单元中,左格为ⅡA族、上格为零族、右格为ⅦA族、下格为VIA族,对于白色格以H元素开始,按逆时针方向旋转,灰色格按逆时针方向旋转,原子序数依次增大。白格中的稀有气体He、Ne、Ar为零族元素,不属于主族元素,A错误;X为N元素,Z为O元素,二者形成化合物有N2O、NO、N2O3、NO2、N2O4、N2O5,B错误; X为N元素,Y为P元素,非金属性:N>P,故最高价含氧酸的酸性:硝酸>磷酸,C正确;X为N元素,Y为P元素,Z为O元素,非金属性:O>N>P,非金属性越强,形成的气态氢化物越稳定,故氢化物最稳定的是H2O,D错误;正确选项C。


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)2SO2(g)+O2(g) △ v 2 O 5 2SO3(g);△H=﹣196.6KJ/mol,是制备硫酸的重要反应.下列关于该反应的叙述正确的是 . (填字母)
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1 , c2 , 则时间间隔t1~t2内,SO3(g)生成的平均速率为u= c 2 c 1 t 2 t 1
E.使用催化剂V2O5能提高SO2的转化率
F.使用催化剂V2O5会改变该反应的△H
(2)判断该反应达到平衡状态的标志是 .(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.在体积不变的容器中,气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.在体积不变的容器中混合气体,的密度保持不变
f.SO2、O2、SO3的浓度比保持不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500mL稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出NO气体5.6L(标准状况),同时溶液质量增加9.3g,下列判断正确的是( )
A.原溶液中投入铁粉物质的量是0.25mol
B.原溶液中的HNO3浓度是2.0mol/L
C.反应后的溶液中还可以溶解9.6g铜
D.反应后的溶液中c(Fe2+):c(Fe3+)=1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500mL稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出NO气体5.6L(标准状况),同时溶液质量增加9.3g,下列判断正确的是( )
A.原溶液中投入铁粉物质的量是0.25mol
B.原溶液中的HNO3浓度是2.0mol/L
C.反应后的溶液中还可以溶解9.6g铜
D.反应后的溶液中c(Fe2+):c(Fe3+)=1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于1molL-1硫酸溶液的说法中正确的是( )
A. 1L水中含有1mol H2SO4
B. 1L溶液中含有1mol H+
C. 1L硫酸溶液中含有96g SO42-
D. 将98g H2SO4溶于1L水中配成上述溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中可行的是( )
A. 用澄清石灰水检验CO中是否含有CO2
B. 用BaCl2除去NaOH溶液中混有的少量Na2SO4
C. 用酒精把碘水中的碘萃取出来
D. 用溶解、过滤的方法分离CaCl2和NaCl固体混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 标准状况下,O2的体积约为22.4 L
B. 标准状况下,CO2的气体摩尔体积为22.4 L
C. 标准状况下,0.5 mol的H2O的体积约为11.2 L
D. 0℃,101kPa时,1 mol O2和N2的混合气体的总体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下面的装置中,A是实验室制备Cl2的发生装置,圆底烧瓶中盛放的是二氧化锰,C、D为气体净化装置;E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶:烧杯G为尾气吸收装置。试回答:
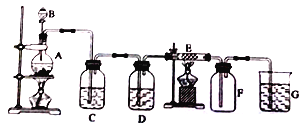
(1)C装置中试剂为______。
(2)E中的现象为______。
(3)写出在A、G中发生反应的离子方程式:A: ___________。G: ________________。
(4)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2 KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①考试用“单线桥”标出电子转移的方向和数目: __________。
②该反应中被氧化和未被氧化的HCl的物质的量之比是________,如果将20mL、12mol/L的浓盐酸与足量KMnO4充分反应,实际能收集到氯气在标准状况下的体积为_______。
A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com