
| A. | ClO3->BrO3->Cl2>Fe3+>I2 | B. | BrO3->Cl2>ClO3->I2>Fe3+ | ||
| C. | BrO3->ClO3->Cl2>Fe3+>I2 | D. | BrO3->ClO3->Fe3+>Cl2>I2 |
分析 氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,据此对该反应进行判断.
解答 解:①中BrO3-是氧化剂,ClO3-是氧化产物,所以氧化性BrO3->ClO3-,
②中ClO3-是氧化剂,Cl2是氧化产物,所以氧化性ClO3->Cl2,
③中Cl2是氧化剂,Fe3+是氧化产物,所以氧化性:Cl2>Fe3+,
④中Fe3+是氧化剂,I2是氧化产物,所以氧化性:Fe3+>I2,
综上得氧化性顺序为:BrO3->ClO3->Cl2>Fe3+>I2,
故选C.
点评 本题考查氧化性强弱的判断,题目难度不大,明确氧化还原反应中氧化性、还原性强弱判断规律为解答关键,注意掌握氧化剂、还原剂的概念及判断方法,试题培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 可根据硫酸密度的大小判断铅蓄电池是否需要充电 | |
| B. | 当物质中的化学键发生断裂时,一定发生化学变化 | |
| C. | 淀粉和纤维素的化学式均为(C6H10O5)n,故互为同分异构体 | |
| D. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨).
某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
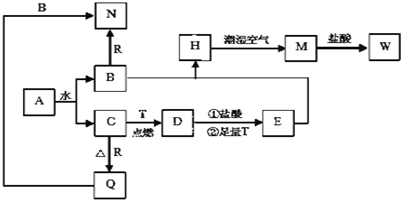
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
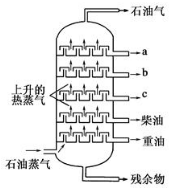
| A. | 在a、b、c三种馏分中,a的熔点最高 | |
| B. | 分馏产品的沸点:a>b>c>柴油>重油 | |
| C. | 在a、b、c三种馏分中,c的平均相对分子质量最大 | |
| D. | a、b、c、柴油、重油都是纯净物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com