
·ÖĪö £Ø1£©C»¹Ō¶žŃõ»Æ¹čÖĘ“Ö¹č£»
£Ø2£©øßĪĀĻĀĒāĘųÓėĖÄĀČ»Æ¹č£ØSiCl4£©·“Ó¦æÉÖʵĆøß“æ¶ČµÄ¹č£¬Ķ¬Ź±Éś³ÉĀČ»ÆĒāĘųĢ壮
½ā“š ½ā£ŗ£Ø1£©C»¹Ō¶žŃõ»Æ¹čÖĘ“Ö¹č£¬»Æѧ·“Ó¦ĪŖSiO2+2C$\frac{\underline{\;øßĪĀ\;}}{\;}$Si+2CO”ü£¬
¹Ź“š°øĪŖ£ŗSiO2+2C$\frac{\underline{\;øßĪĀ\;}}{\;}$Si+2CO”ü£»
£Ø2£©øßĪĀĻĀĒāĘųÓėĖÄĀČ»Æ¹č£ØSiCl4£©·“Ó¦æÉÖʵĆøß“æ¶ČµÄ¹č£¬Ķ¬Ź±Éś³ÉĀČ»ÆĒāĘųĢ壬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ2H2+SiCl4$\frac{\underline{\;øßĪĀ\;}}{\;}$Si+4HCl£®
¹Ź“š°øĪŖ£ŗ2H2+SiCl4$\frac{\underline{\;øßĪĀ\;}}{\;}$Si+4HCl£®
µćĘĄ ±¾Ģāæ¼²éĮĖ¹č¼°Ęä»ÆŗĻĪļŠŌÖŹ£¬²ąÖŲ漲鷓Ӧ·½³ĢŹ½µÄŹéŠ“£¬Ć÷Č·“Ö¹čÖʱøŌĄķ¼°Ģį“æŌĄķŹĒ½āĢā¹Ų¼ü£¬ĢāÄæÄŃ¶Č²»“ó£®


 ʷѧĖ«ÓžķĻµĮŠ“š°ø
ʷѧĖ«ÓžķĻµĮŠ“š°ø Š”ѧʌĩ³å“Ģ100·ÖĻµĮŠ“š°ø
Š”ѧʌĩ³å“Ģ100·ÖĻµĮŠ“š°ø ĘŚÄ©ø“Ļ°¼ģ²āĻµĮŠ“š°ø
ĘŚÄ©ø“Ļ°¼ģ²āĻµĮŠ“š°ø ³¬ÄÜѧµäµ„ŌŖĘŚÖŠĘŚÄ©×ØĢā³å“Ģ100·ÖĻµĮŠ“š°ø
³¬ÄÜѧµäµ„ŌŖĘŚÖŠĘŚÄ©×ØĢā³å“Ģ100·ÖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ģ¼ĖįĒāÄĘČÜŅŗÖŠµĪ¼ÓĻ”ŃĪĖį | B£® | ĮņĖįĢśČÜŅŗÖŠµĪ¼ÓĮņĒč»Æ¼ŲČÜŅŗ | ||
| C£® | µāĖ®ÖŠµĪ¼Óµķ·Ūµā»Æ¼ŲČÜŅŗ | D£® | ĀČ»ÆĢśČÜŅŗÖŠ¼ÓČė»¹ŌŠŌĢś·Ū |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Åš”¢ĀĮ”¢ļŲ | B£® | µŖ”¢Į×”¢Éé | C£® | Ķ”¢Ņų”¢½š | D£® | Šæ”¢ļÓ”¢¹Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
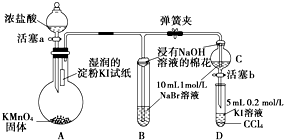 ŹµŃéĢāĪŖŃéÖ¤Ā±ĖŲµ„ÖŹŃõ»ÆŠŌµÄĒæČõ£¬Ä³Š”×éÓĆČēĶ¼ĖłŹ¾×°ÖĆ½ųŠŠŹµŃé£Ø¼Š³ÖŅĒĘ÷ŅŃĀŌČ„£¬ĘųĆÜŠŌŅŃ¼ģŃ飩£®
ŹµŃéĢāĪŖŃéÖ¤Ā±ĖŲµ„ÖŹŃõ»ÆŠŌµÄĒæČõ£¬Ä³Š”×éÓĆČēĶ¼ĖłŹ¾×°ÖĆ½ųŠŠŹµŃé£Ø¼Š³ÖŅĒĘ÷ŅŃĀŌČ„£¬ĘųĆÜŠŌŅŃ¼ģŃ飩£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CH3CH2Br+NaOH$”ś_{”÷}^{H_{2}O}$CH2=CH2”ü+NaBr+H2O | |
| B£® | 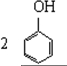 +3Br2”ś +3Br2”ś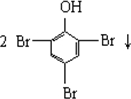 | |
| C£® | nCH2=CH-CH3$\stackrel{Ņ»¶ØĢõ¼ž}{”ś}$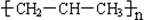 | |
| D£® | CH3CHO+NaOH+2Cu£ØOH£©2$\stackrel{¼ÓČČ}{”ś}$ CH3COONa+Cu2O”ż+3H2O£® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½šŹōŌŖĖŲÓė·Ē½šŹōŌŖĖŲŠĪ³ÉµÄ»Æѧ¼üŅ»¶ØŹĒĄė×Ó¼ü | |
| B£® | ¢ńA×åŗĶ¢÷A×åŌ×Ó»ÆŗĻŹ±£¬Ņ»¶ØÉś³ÉĄė×Ó¼ü | |
| C£® | ½ö·Ē½šŹōŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļÖŠŅ»¶Ø²»ŹĒĄė×Ó¼ü | |
| D£® | »īĘĆ½šŹōÓė»īĘĆ·Ē½šŹō»ÆŗĻŹ±£¬ÄÜŠĪ³ÉĄė×Ó¼ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
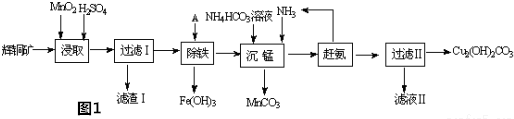

²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com