
【题目】120 mL浓度为1 mol·L-1的Na2SO3溶液,恰好与100 mL浓度为0.4 mol·L-1的K2Cr2O7溶液完全反应,在还原产物中Cr元素的化合价
A. +3 B. +1 C. +4 D. +2
科目:高中化学 来源: 题型:
【题目】元素X和Y是同周期主族元素,X元素在第ⅠA族,Y元素在第ⅦA族,则X和Y两元素原子序数之差不可能是( )
A. 6 B. 16 C. 26 D. 30
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是
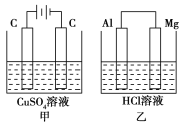
A.溶液的质量变化:甲减小,乙增大
B.溶液pH变化:甲减小,乙增大
C.相同条件下产生气体的体积:V甲=V乙
D.电极反应式:甲中阴极:Cu2++2e-===Cu,乙中负极:Mg-2e-===Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,a、b、c…为部分元素.回答下列问题:
a | |||||||||||||||||
f | y | h | i | ||||||||||||||
b | e | j | |||||||||||||||
c | d | g | l | ||||||||||||||
(1)请写出上述元素d3+的核外电子排布式;
(2)请比较y,h,i三种元素的第一电离能由大到小的顺序(写元素符号),其原因是 .
(3)请写出e元素的原子价电子排布图;
(4)ya3分子的电子式是 , 其分子的空间构型是 , 分子中y原子的原子轨道的杂化类型是 .
(5)b、e两种元素中,金属性较强的是(填元素符号),写出能证明这一结论的一个实验事实 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖.在密闭容器中,将2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
(1)当反应达到平衡时,N2和H2的浓度比是____;N2和H2的转化率比是____.反应放出的热量___(填“大于”“小于”或“等于”)184.8 kJ。
(2)降低平衡体系的温度(保持体积不变),混合气体的平均相对分子质量____,密度____.平衡常数K_________(填“增大”“减小”或“不变”).
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_____(填“正向”“逆向”或“不”)移动.
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_____(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度_____(填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com