
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
实验室要配制1mol/L的稀硫酸250mL,回答下列问题:
① 需要98%密度为1.84g/cm3的浓硫酸 mL。
② 配制时,必须使用的仪器除 20 mL量筒, 250 mL容量瓶,玻璃棒外,还需要的仪器有 。
③ 配制时,该实验两次用到玻璃棒,其作用分别是 、 。
④ 配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”、“偏低”或“不影响”)没有洗涤烧杯和玻璃棒 ;容量瓶没有干燥 。
(2)用如下图所示装置(夹持仪器省略,暂不考虑尾气的吸收)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
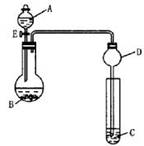
① 如何检验该装置的气密性 。
② 若A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中的现象为________________ ;B中发生反应的化学方程式为_____________ 。
③ 若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是___________________ ;B中发生反应的离子方程式为_________________ 。
④ 图中D装置在实验中的作用是____________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com