
【题目】相同条件下,下列各组热化学方程式(溶液中的反应均是在稀溶液之间进行)中,ΔH2>ΔH1的是
A.CO2(s)+C(s)=2CO(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
B.NH3 ·H2O(aq)+H+(aq)= NH4+ (aq)+H2O(l) ΔH1 H+(aq)+OH-(aq)= H2O(aq) ΔH2
C.N2(g)+O2 (g) ![]() 2NO(g) △H1 N2(g)+O2 (g)
2NO(g) △H1 N2(g)+O2 (g) ![]() 2NO(g) △H2
2NO(g) △H2
D.CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) △H1 CH4(g)+2O2(g)= CO2(g)+ 2H2O(g) △H2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:①![]() ②
②![]() ③
③![]() 由此判断下列说法正确的是()
由此判断下列说法正确的是()
A.铁元素在反应①中被还原,在③中被氧化
B.反应②中当有1molCl2被氧化时,有2molBr—被还原
C.氧化性强弱顺序为:![]()
D.还原性强弱顺序为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究。
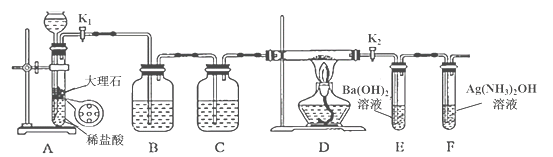
(1)气体产物成分的探究。小组成员采用如图装置(可重复选用)进行实验:

①装置D的名称为____。
②按照气流从左到右的方向,上述装置的连接顺序为____→尾气处理装置(填图中各仪器接口的字母编号)。
③实验前先通入一段时间N2,其目的为____。
④实验证明了气体产物中含有CO,依据的实验现象为_____。
(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。小组成员设计实验证明了其成分只有FeO,其实验操作及现象为:___。
(3)依据(1)和(2)结论,可知A处反应管中发生反应的化学方程式为:___。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下(杂质不参与反应):
步骤1:称取2g草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液。
步骤2:取上述溶液25.00mL,向其中加入0.01mol·L1KMnO4溶液,恰好完全反应时消耗 KMnO4溶液30mL。
[已知:FeC2O4+KMnO4+H2SO4→Fe2(SO4)3+CO2↑+MnSO4+K2SO4+H2O(未配平)]
(4)草酸亚铁晶体样品的纯度为____;若步骤1配制溶液时部分Fe2+被氧化,则测定结果将____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
回答下列问题:
(1)B中的溶液为______________。
(2)先称量硬质玻璃管的质量为ml g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊 e.关闭K1和K2 f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3; 假设二:只有Na2O; 假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
步骤 | 操作和现象 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子(或分子)结构如表所示:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:______。
(2)元素Y与元素Z相比,金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______(填字母)。
A.Y单质的熔点比Z单质低
B.Y的化合价比Z低
C.Y单质与水反应比Z单质与水反应剧烈
D.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:______。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)______r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物X、Y、A、B、C、D、E、F、G之间的转化关系如图所示。
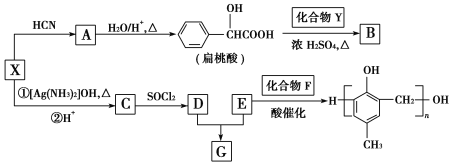
已知:①![]()
②![]() (R、R'代表烃基)
(R、R'代表烃基)
③X在催化剂作用下可与H2反应生成化合物Y;
④化合物F的核磁共振氢谱图中只有一个吸收峰。
请回答下列问题:
(1)X的含氧官能团的名称是________________________,X与HCN反应生成A的反应类型是_______________________。
(2)酯类化合物B的分子式是C15H14O3,其结构简式是__________________________。
(3)X发生银镜反应的化学方程式是:________________________。
(4)G在NaOH溶液中发生水解反应的化学方程式是_______________________。
(5)![]() 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应。满足上述条件的同分异构体共有________种(不考虑立体异构)。
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应。满足上述条件的同分异构体共有________种(不考虑立体异构)。
(6)写出以C2H5OH为原料合成乳酸(![]() )的路线(其他试剂任选)。________________________________________________________________________。
)的路线(其他试剂任选)。________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用一定量铜片和50 mL浓度为2.0 mol/L的硝酸反应,当铜片完全溶解时收集到标准状况下280 mL的一氧化氮。请回答(忽略溶液体积变化):
(1)反应后溶液呈_______性(用“酸”、“碱”或“中”填空);
(2)反应后溶液中铜离子的物质的量浓度是多少_______(写出计算过程,保留三位有效数字)?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲配制0.2mol/L的CuSO4溶液98mL,并探究硫酸铜的性质。实验室有两种不同的试剂可供选用:① CuSO4·5H2O晶体;②16%的CuSO4溶液 (ρ=2.3 g/mL)。回答下列问题:
(1)配制该硫酸铜溶液应选用的玻璃仪器除量筒、烧杯和玻璃棒外,还有________。
(2)若取用①来配置该硫酸铜溶液,需用托盘天平称量_______g;若取用②来配置,所选用硫酸铜溶液的体积为_______mL。
(3)若取用②来配置,下列操作会使得所配硫酸铜溶液浓度偏低的是____(填编号)。
a.量取硫酸铜溶液的量筒未用蒸馏水洗涤 b.容量瓶中有少量水
c.定容摇匀时,液面下降又加水 d.定容时仰视刻度线
(4)取所配硫酸铜溶液,往其中加入BaCl2溶液,观察有白色沉淀出现。如何证明所取溶液中的硫酸根离子沉淀完全?________。
(5)课堂上,老师演示了金属钠与CuSO4溶液反应的实验,大家都观察到有蓝色沉淀生成,用化学反应方程式解释原因_________。个别较细心的同学还发现生成的蓝色沉淀中混有少量黑色难溶物,而所使用的药品均没有问题,该黑色难溶物是________(填化学式),猜测生成该黑色难溶物的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等重要优点。镍钴锰三元材料中Ni为主要活泼元素,通常可以表示为:LiNiaCobMncO2,其中a+b+c=1,可简写为LiAO2。充电时总反应为LiAO2 + nC = Li1-xAO2 + LixCn(0<x<1),工作原理如下图所示,则以下说法正确的是( )

A. 放电时Ni元素最先失去电子
B. 放电时电子从a电极由导线移向b电极
C. 充电时的阳极反应式为LiAO2 - xe-= Li1-xAO2 + xLi+
D. 充电时转移1mol电子,理论上阴极材料质量增加7g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com