
| A. | 16O和18O | B. | 正丁烷和异丁烷 | C. | 金刚石和石墨 | D. | CH4和CH3CH3 |
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;互为同系物的物质满足以下特点:结构相似、化学性质相似、分子式通式相同、分子式不同、物理性质不同,研究对象是有机物;
具有相同分子式而结构不同的化合物互为同分异构体;
同素异形体是同种元素形成的不同单质,据此进行判断.
解答 解:A.16O和18O都是氧元素的不同原子,二者互为同位素,故A错误;
B.正丁烷和异丁烷的分子式相同、结构不同,二者互为同分异构体,故B错误;
C.金刚石和石墨都是碳元素的不同单质,二者互为同素异形体,故C错误;
D.甲烷和乙烷分子中的化学键都是单键,属于饱和烃,二者结构相似,分子间相差1个CH2原子团,所以二者互为同系物,故D正确;
故选D.
点评 本题考查了同分异构体、同素异形体、同系物的判断,题目难度不大,注意掌握同系物、同素异形体、同位素、同分异构体的概念及区别,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 质子数是212 | B. | 中子数是130 | C. | 电子数是194 | D. | 质量数是82 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
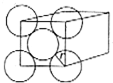 金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为A cm,求:
金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为A cm,求:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 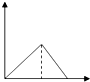 | B. | 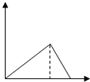 | C. | 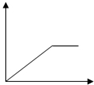 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ③④⑥ | C. | ①②④ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
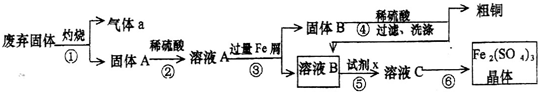
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molFe与过量的氯气反应,转移电子的数目为2 NA | |
| B. | 2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| C. | 1.0L0.1 mol•L-1Na2S溶液中含有的S2-离子数小于0.1NA | |
| D. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com