
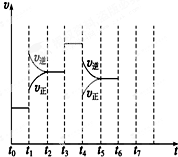
 ŌŚŅ»ĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦N2+3H22NH3£¬”÷H£¼0“ļµ½Ę½ŗāŗó£¬Ö»øıäijŅ»øöĢõ¼žŹ±£¬·“Ó¦ĖŁĀŹÓė·“Ó¦Ź±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ»Ų“šĻĀĮŠĪŹĢā£ŗ
ŌŚŅ»ĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦N2+3H22NH3£¬”÷H£¼0“ļµ½Ę½ŗāŗó£¬Ö»øıäijŅ»øöĢõ¼žŹ±£¬·“Ó¦ĖŁĀŹÓė·“Ó¦Ź±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ»Ų“šĻĀĮŠĪŹĢā£ŗ·ÖĪö £Ø1£©øł¾ŻĶ¼Ź¾½įŗĻvÕż=vÄę£¬ÅŠ¶ĻŹĒ·ń“¦ÓŚĘ½ŗāדĢ¬£»
£Ø2£©ÓÉĶ¼æÉÖŖ£¬t1ÕżÄę·“Ó¦ĖŁĀŹ¾łŌö“ó£¬ĒŅÄę·“Ó¦ĖŁĀŹ“óÓŚÕż·“Ó¦ĖŁĀŹ£»t3ÕżÄę·“Ó¦ĖŁĀŹĶ¬µČ³Ģ¶ČµÄŌö“ó£»t4Ź±ÕżÄę·“Ó¦ĖŁĀŹ¾ł¼õŠ”£¬ĒŅÄę·“Ó¦ĖŁĀŹ“óÓŚÕż·“Ó¦ĖŁĀŹ£»
£Ø3£©ÓÉĶ¼æÉÖŖ£¬t1Ę½ŗāÄęĻņŅĘ¶Æ£¬t3²»ŅĘ¶Æ£¬t4Ę½ŗāÄęĻņŅĘ¶Æ£¬øł¾ŻŅĘ¶Æ½į¹ū·ÖĪö£»
£Ø4£©Éč·“Ó¦Ē°¼ÓČėa mol N2£¬b mol H2£¬“ļĘ½ŗāŹ±Éś³É2x mol NH3£¬øł¾ŻČż¶ĪŹ½ŗĶ°±ĘųµÄĢå»ż·ÖŹż¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©øł¾ŻĶ¼Ź¾æÉÖŖ£¬t0”«t1”¢t2”«t3”¢t3”«t4”¢t5”«t6Ź±¼ä¶ĪÄŚ£¬vÕż”¢vÄęĻąµČ£¬·“Ó¦“¦ÓŚĘ½ŗāדĢ¬£¬¹Ź“š°øĪŖ£ŗACDF£»
£Ø2£©ÓÉN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H£¼0£¬æÉÖŖ£¬øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ĒŅĪŖĘųĢåĢå»ż¼õŠ”µÄ·“Ó¦£¬ŌņÓÉĶ¼æÉÖŖ£¬t1ÕżÄę·“Ó¦ĖŁĀŹ¾łŌö“ó£¬ĒŅÄę·“Ó¦ĖŁĀŹ“óÓŚÕż·“Ó¦ĖŁĀŹ£¬øıäĢõ¼žÓ¦ĪŖÉżøßĪĀ¶Č£»
t3ÕżÄę·“Ó¦ĖŁĀŹĶ¬µČ³Ģ¶ČµÄŌö“ó£¬øıäĢõ¼žÓ¦ĪŖŹ¹ÓĆ“ß»Æ¼Į£»
t4Ź±ÕżÄę·“Ó¦ĖŁĀŹ¾ł¼õŠ”£¬ĒŅÄę·“Ó¦ĖŁĀŹ“óÓŚÕż·“Ó¦ĖŁĀŹ£¬øıäĢõ¼žÓ¦ĪŖ¼õŠ”Ń¹Ē棬
¹Ź“š°øĪŖ£ŗC£»E£»B£»
£Ø3£©ÓÉĶ¼æÉÖŖ£¬t1Ę½ŗāÄęĻņŅĘ¶Æ£¬t3²»ŅĘ¶Æ£¬t4Ę½ŗāÄęĻņŅĘ¶Æ£¬¾łŹ¹°±ĘųµÄŗ¬Įæ¼õÉŁ£¬Ōņt0”«t1°±ĘųµÄŗ¬Įæ×ī“ó£¬
¹Ź“š°øĪŖ£ŗA£»
£Ø4£©Éč·“Ó¦Ē°¼ÓČėa mol N2£¬b mol H2£¬“ļĘ½ŗāŹ±Éś³É2x mol NH3£¬
N2£Øg£©+3H2£Øg£©?2NH3£Øg£©
ĘšŹ¼ a b 0
×Ŗ»Æ x 3x 2x
Ę½ŗā a-x b-3x 2x
Ōņ·“Ó¦ŗóĘųĢå×ܵÄĪļÖŹµÄĮæ=£Øa+b-2x£©mol£¬$\frac{2x}{a+b-2x}$=0.2£¬½āµĆ£ŗa+b=12x£¬¹Ź·“Ó¦ŗóÓė·“Ó¦Ē°µÄ»ģŗĻĘųĢåĢå»żÖ®±Č=$\frac{a+b-2x}{a+b}$=$\frac{12x-2x}{12x}$=$\frac{5}{6}$£¬
¹Ź“š°øĪŖ£ŗ5£ŗ6£®
µćĘĄ ±¾Ģāæ¼²éÓ°Ļģ»Æѧ·“Ó¦ĖŁĀŹĶ¼Ļó·ÖĪö£¬²ąÖŲæ¼²éѧɜ·ÖĪöÅŠ¶Ļ¼°¼ĘĖćÄÜĮ¦£¬°ŃĪÕ·“Ó¦µÄĢŲµć¼°Ķ¼Ļó·ÖĪöŹĒ½ā“šµÄ¹Ų¼ü£¬Ć÷Č·ĪĀ¶Č”¢Ń¹Ē攢“߻ƼĮ¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ¼“æɽā“š£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | FeCl2 | B£® | Fe£ØOH£©3 | C£® | CO | D£® | H2SiO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Č«²ææÉŅŌ | B£® | ½ö¢Ł²»æÉŅŌ | C£® | ½ö¢ŚæÉŅŌ | D£® | ½ö¢ŪæÉŅŌ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓĆ¼ÓČČ·Ø·ÖĄėÄąÉ³ÖŠµÄµāµ„ÖŹ | B£® | øɱłĘų»Æ | ||
| C£® | µē½āĖ® | D£® | ÓĆÕōĮó·ØÖĘČ”ÕōĮóĖ® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĀČĘųÓėÉÕ¼īČÜŅŗ·“Ó¦ Cl2+2OH-=Cl-+ClO-+H2O | |
| B£® | Ńõ»ÆĀĮŗĶĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦ Al3++3OH-=Al£ØOH£©3”ż | |
| C£® | ÄĘŗĶĖ®·“Ó¦ Na+2H2O=Na++2OH-+H2”ü | |
| D£® | ĻņĻ”ĀČ»Æļ§Ļ”ČÜŅŗÖŠ¼ÓČėĻ”ÉÕ¼īČÜŅŗ NH4++OH-=NH3”ü+H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na2SČÜŅŗĻŌ¼īŠŌ£ŗS2-+2H2O?H2S+2OH- | |
| B£® | ÓĆÅű„ŗĶŹ³ŃĪĖ®·ØŹÕ¼ÆCl2£ŗCl2+H2O?H++Cl-+HClO | |
| C£® | ²ŻĖįČÜŅŗŹ¹øßĆĢĖį¼ŲĖįŠŌČÜŅŗĶŹÉ«£ŗ2MnO4-+5H2C2O4+6H+ØT2Mn2++10CO2”ü+8H2O | |
| D£® | ĻņĪŪĖ®ÖŠĶ¶·ÅĆ÷·Æ£¬Éś³ÉÄÜÄż¾ŪŠüø”ĪļµÄ½ŗĢå£ŗAl3++3H2O?Al£ØOH£©3£Ø½ŗĢ壩+3H+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com