
【题目】设NA为阿伏加德罗常数,则下列叙述中正确的是
A. 6.02×1022个H2SO分子在水中可电离生成2NA个H+
B. 在0℃、101kPa时,22.4L氢气中含有NA个氢原子
C. 14g氮气中含有7NA个电子
D. NA个一氧化碳分子和0.5mol甲烷的质量比为7︰4
【答案】C
【解析】
A.6.02![]() 个H2SO4的物质的量为:n=
个H2SO4的物质的量为:n=![]() =0.1mol,0.1mol硫酸在水中能电离生成0.2mol氢离子,即0.2NA个氢离子,故A错误;
=0.1mol,0.1mol硫酸在水中能电离生成0.2mol氢离子,即0.2NA个氢离子,故A错误;
B.0℃、101kPa即标况,气体摩尔体积为22.4L/mol,则22.4L氢气的物质的量,n=![]() =1mol,1mol氢气含2mol氢原子,,即2NA个,故B错误;
=1mol,1mol氢气含2mol氢原子,,即2NA个,故B错误;
C.14g氮气的物质的量为:n=![]() =0.5mol,而1mol氮气含14mol电子,故0.5mol氮气含7mol电子,即7NA个电子,故C正确;
=0.5mol,而1mol氮气含14mol电子,故0.5mol氮气含7mol电子,即7NA个电子,故C正确;
D.NA个CO的物质的量是1mol,1molCO质量为:m=1mol![]() =28g,0.5mol甲烷的质量m=0.5mol
=28g,0.5mol甲烷的质量m=0.5mol![]() =8g,故质量比为28g:8g=7:2,故D错误;
=8g,故质量比为28g:8g=7:2,故D错误;
本题答案为C。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的叙述中,错误的是
A.单质硅是良好的半导体材料
B.硅和碳是都是第ⅣA族的元素
C.二氧化硅用来制造通讯材料(光导纤维)
D.二氧化硅溶于水生成硅酸,它是挥发性酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素在生物体内的含量分布情况,下列表述不正确的是( )
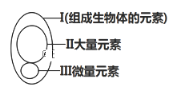
A. Ⅰ在非生物界中都能找到,体现了生物界与非生物界的统一性
B. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. P、S、K、Ca、Zn属于大量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )

A. 阳极产物一定是Cl2,阴极产物一定是Cu
B. 整个过程中阳极先产生Cl2,后产生O2
C. BC段表示在阴极上是H+放电产生了H2
D. CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBH4容易与H+反应产生氢气而成为储氢材料研究的热点。以硼酸为原料制备NaBH4的一种工艺流程如下图所示:
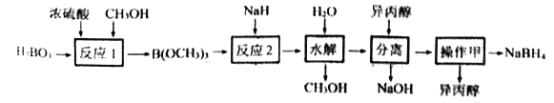
已知: ①H3BO3电离:H3BO3+H2O![]() [B(OH)4]-+H+
[B(OH)4]-+H+
②反应1: H3BO3+3CH3OH![]() B(OCH3)3+3H2O
B(OCH3)3+3H2O
③反应2:B(OCH3)3+4NaH= NaBH4+ 3CH3ONa
(1)H3BO3是____元酸,NaH的电子式为_______________。
(2)NaBH4与水剧烈反应放出H2。反应的化学方程式为________________。
(3)反应1属于______(填有机反应类型),反应过程中蒸出B(OCH3)3的目的是__________。
(4)“水解”时产生的大量NaOH,减缓了NaBH4与水的反应。在该步骤中,与水反应生成大量NaOH的物质是_________。
(5)“分离”后得到NaBH4的异丙醇溶液。操作甲是_____________。
(6)上述流程中可以循环使用的物质是____________。
(7)以惰性电极电解Na[B(OH)4]与NaOH 混合溶液也能制得NaBH4。阴极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒容密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的尾气主要成分为N2、NO、CO、CO2、SO2等,某兴趣小组设计以下实验,定量检测尾气中污染性气体的含量。
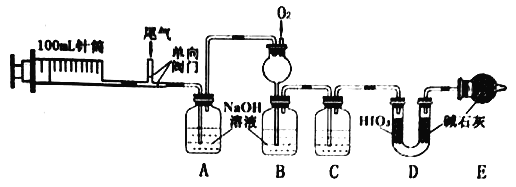
(1)实验时,先推送N2,再连续抽送20次(100mL/次)尾气,最后推送N2。
①第一次推送N2的作用是________。
②尾气采用多次抽送方式的目的是________。
(2)C中的试剂是____________。
(3)装置D用于测量CO。
①HIO3能氧化CO,还原产物为I2,反应的化学方程式为____________。
②D中碱石灰的作用是_________。
(4)为进一步分析SO2含量,将实验后A中溶液转移到烧杯,依次加入三种试剂,过滤、洗涤、干燥。称得沉淀为1.165g。
①加入的三种试剂为_______。(选填序号)
a.盐酸 b.双氧水 c.BaCl2溶液 d.稀硫酸
②检验沉淀是否洗涤干净的方法是_____________。
③尾气中SO2含量为_____gL-1。
(5)实验后,测得B中溶液体积为100mL,NO2-、NO3- 的浓度分别为0.0100molL-1和0.0200molL-1。
①B中长颈漏斗的作用是_____________;
②通入O2的体积(标准状况)至少为___________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A. 图Ⅰ表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H=-241.8 kJ·mol-1
B. 图Ⅱ表示反应A2 (g)+ 3B2 (g)![]() 2AB3(g),达到平衡时A2的转化率大小为:b>a>c
2AB3(g),达到平衡时A2的转化率大小为:b>a>c
C. 图Ⅲ表示0.1mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
D. 图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com