
【题目】某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如下图所示:
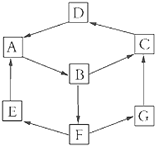
已知①A、B、C、D、G含有同种元素。
②
纯A(单质) | B溶液 | D固体 | G溶液 | |
颜色 | 银白色 | 黄色 | 红棕色 | 浅绿色 |
③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G。
依据以上信息填空:
(1)写出D的化学式:___________________________________________。
(2)G生成C的过程中所出现的现象为_________________________。
(3)写出反应A→B的化学方程式:_________________________________。
(4)B→F的离子方程式为________;G与次氯酸反应的离子方程式为________________________________。
【答案】Fe2O3 先产生白色沉淀,迅速变为灰绿色,最后变为红褐色 2Fe+3Cl2![]() 2FeCl3 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ H++2Fe2++HClO=2Fe3++Cl-+H2O
2FeCl3 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ H++2Fe2++HClO=2Fe3++Cl-+H2O
【解析】
结合框图,D固体呈红棕色,则其为Fe2O3;A、B、C、D、G含有同种元素,B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,则B为FeCl3,G中含有Fe2+,A为Fe。由“B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G”,则F为 H2SO4,G为FeSO4;E是通常情况下密度最小的气体,则E为H2。由B→C→D的转化可推知,C为Fe(OH)3。
(1)由以上分析可知,D为氧化铁,其化学式:Fe2O3。答案为:Fe2O3;
(2)FeSO4生成Fe(OH)3,可先加碱、后氧化,所出现的现象为先产生白色沉淀,迅速变为灰绿色,最后变为红褐色。答案为:先产生白色沉淀,迅速变为灰绿色,最后变为红褐色;
(3)反应Fe→FeCl3需用Cl2将Fe氧化,反应方程式为2Fe+3Cl2![]() 2FeCl3。答案为:2Fe+3Cl2
2FeCl3。答案为:2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(4)FeCl3→H2SO4,应使用SO2,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;FeSO4与次氯酸反应,生成Fe3+、Cl-和H+,离子方程式为H++2Fe2++HClO=2Fe3++Cl-+H2O。答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;H++2Fe2++HClO=2Fe3++Cl-+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素下列说法不正确的是( )
![]()
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的气态氢化物的稳定性比Z的弱
D. M的原子半径比Y的原子半径大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有三个不成对的电子;C元素可分别与A、B、D生成RC2型化合物,其中的DC2与C3互为等电子体。下列叙述中不正确的是
A. D原子的简化电子排布式为[Ar]3s23p4
B. B、C两元素的第一电离能大小关系为B>C
C. 用电子式表示AD2的形成过程为![]()
D. 由B60分子形成的晶体与A60相似,分子中总键能:B60>A60
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
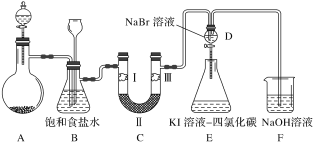
(1)制备氯气选用的药品为二氧化锰和浓盐酸,则相关的化学反应方程式为:_____。
(2)装置B中饱和食盐水的作用是___________ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ应依次放入_____。(填字母)
a | b | c | d | |
Ⅰ | 干燥的 有色布条 | 湿润的 有色布条 | 湿润的 有色布条 | 干燥的 有色布条 |
Ⅱ | 碱石灰 | 无水CaCl2 | 浓硫酸 | 无水CaCl2 |
Ⅲ | 湿润的 有色布条 | 干燥的 有色布条 | 干燥的 有色布条 | 湿润的 有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为橙黄色,打开D装置中活塞,将D中少量溶液加入装置E中,振荡。观察到的现象是_________。经认真考虑,有同学提出该实验方案仍有不足,请说明其中原因___________。
(5)装置F中用足量NaOH溶液吸收剩余的氯气,试写出相应的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是( )
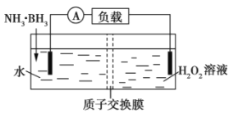
A.正极的电极反应式为2H++2e-═H2↑
B.电池工作时,H+通过质子交换膜向负极移动
C.电池工作时,正、负极分别放出H2和NH3
D.工作一段时间后,若左右两极室质量差为1.9g,则电路中转移0.6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。_______
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。

(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性。下列叙述中不正确的是:
A. 红热的铜丝在氯气中剧烈燃烧,生成棕黄色烟
B. 钠在氯气中燃烧,生成白色的烟
C. 纯净的氢气在氯气中安静的燃烧,在集气瓶口形成白色烟雾
D. 氯气能与水反应生成盐酸和次氯酸,次氯酸见光易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存的是( )
A.在pH=0的溶液中:![]() 、Al3+、OH-、
、Al3+、OH-、![]()
B.在新制氯水中:Fe2+、Mg2+、![]() 、Cl-
、Cl-
C.在加入NH4HCO3产生气体的溶液中:Na+、Ba2+、Cl-、![]()
D.加入Al片能产生H2的溶液:![]() 、Ca2+、
、Ca2+、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源。海水综合利用的部分流程图如下:
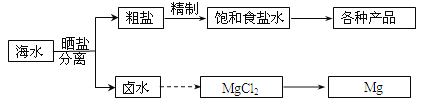
回答下列问题:
(1)用NaCl做原料可以得到多种产品
①工业上由NaCl制备金属钠的化学方程式是________________。
②实验室用惰性电极电解200mLNaCl溶液,若阴阳两极均得到224mL气体(标准状况),则所得溶液的pH为_________(忽略反应前后溶液的体积变化)。
③电解氯化钠稀溶液可制备“84”消毒液。“84”消毒液的有效成分为______,制取它的化学方程式为__________________________。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl26H2O;
d.将MgCl26H2O在一定条件下可以得到无水MgCl2;
e.电解熔融的MgCl2可得到Mg。
①上述提取镁的流程c中,得到MgCl2溶液的离子方程式为______________。
②步骤d中的“一定条件”指的是___________________。
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?__________(填“同意”或“不同意”),请说出你同意或不同意的理由______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com