



科目:高中化学 来源: 题型:
| A、XY |
| B、XY2 |
| C、XY3 |
| D、XY4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
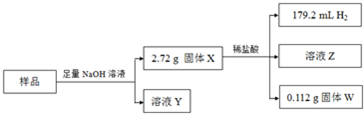
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
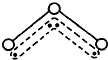 O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
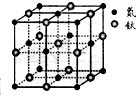 现有5种短周期元素A、B、C、D、E,原子序数依次增大.A的同位素中有一种核素无中子,B最外层上电子数是次外层电子数的两倍,C元素最简单的氢化物Y的水溶液呈碱性,E是短周期中电负性最小的元素.D与可与A、B、C、E四种元素分别形成原子个数比不相同的常见化合物.回答下列问题:
现有5种短周期元素A、B、C、D、E,原子序数依次增大.A的同位素中有一种核素无中子,B最外层上电子数是次外层电子数的两倍,C元素最简单的氢化物Y的水溶液呈碱性,E是短周期中电负性最小的元素.D与可与A、B、C、E四种元素分别形成原子个数比不相同的常见化合物.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 △H=+88.62kJ/mol
△H=+88.62kJ/mol| A、一定条件下,1mol NBD最多可与2 mol Br2发生加成反应 |
| B、物质Q的能量比NBD的低 |
| C、物质Q的一氯取代物只有3种 |
| D、NBD和Q二者互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com