
| A. | X的原子半径一定大于Y的原子半径 | |
| B. | X与Y的简单离子不可能具有相同的电子层结构 | |
| C. | X2Y可能是离子化合物,也可能是共价化合物 | |
| D. | 两元素形成的化合物中,原子个数比不可能为1:1 |
分析 X、Y为短周期元素,X位于IA族,则X可能为H、Li、Na元素,X与Y可形成化合物X2Y,则Y为第ⅥA族元素,Y可能为O、S元素,以此进行解答.
解答 解:X、Y为短周期元素,X位于IA族,则X可能为H、Li、Na元素,X与Y可形成化合物X2Y,则Y为第ⅥA族元素,Y可能为O、S元素,
A.当X为H元素,Y为O、S元素时,X的原子半径小于Y的原子半径,故A错误;
B.X为Na时,其对应离子为Na+,离子有10个电子,Y为O元素时,其对应的离子为O2-,离子有10个电子,二者具有相同的电子层结构,故B错误;
C.化学式为X2Y的有H2O或Na2O或Na2S或H2S等,可能是离子化合物,也可能是共价化合物,故C正确;
D.两元素形成的化合物中,原子个数为1:1的有H2O2或Na2O2,故D错误.
故选C.
点评 本题考查位置结构性质的相互关系及应用,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意元素周期表中各主族元素的主要性质的相似性和递变性的应用.


科目:高中化学 来源: 题型:选择题
| A. | 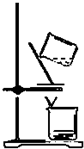 用图所示装置,过滤海带灰浸取液 | |
| B. | 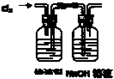 用图所示装置,在滤液中通入Cl2置换I2 | |
| C. | 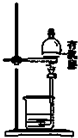 用图所示装置,先放出下层液体,再放出有机层 | |
| D. | 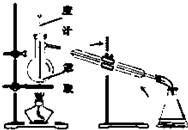 用图所示装置,回收萃取剂苯并获得单质碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8O2 | B. | C2H6O | C. | C4H10O2 | D. | C4H6O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、Cl-、CO32- | B. | H+、Na+、Fe2+、MnO4- | ||
| C. | K+、AlO2-、Cl-、OH- | D. | K+、NH4+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将苯酚晶体放人少量水中,加热至全部溶解,冷却至50℃形成悬浊液 | |
| B. | 苯酚可以和硝酸发生取代反应 | |
| C. | 苯酚易溶于NaOH溶液中 | |
| D. | 苯酚的酸性比碳酸强,比醋酸弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 | B. | 0.2mol•L-1 | C. | 0.5mol•L-1 | D. | 1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
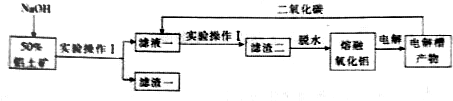
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com