
 如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C分别充入等质量的X、H2、Y三种气体.当隔板静止时,A、C内的气体密度相等,下列说法不正确的是( )
如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C分别充入等质量的X、H2、Y三种气体.当隔板静止时,A、C内的气体密度相等,下列说法不正确的是( )| A. | 摩尔质量:M(X)=M(Y) | B. | 分子的数目:N (X)=N(Y) | ||
| C. | 气体的体积:V(X)=V(Y) | D. | 物质的质量:m(X)<n(H2)<n(Y) |
分析 根据图示可知,在A、B、C处分别充入等质量的X、H2、Y三种气体,且X、Y气体的密度相等,而气体的摩尔质量M=ρ×Vm,所以气体的摩尔质量相等,即相对分子质量相等;气体的物质的量n=$\frac{m}{M}$,而气体的摩尔质量相等,所以物质的量相等;相同温度、压强下X、Y的气体物质的量相同,所以X与Y的体积相同.
解答 解:在A、B、C处分别充入等质量的X、H2、Y三种气体,且X、Y气体的密度相等,而气体的摩尔质量M=ρ×Vm,所以气体的摩尔质量相等,即相对分子质量相等;气体的物质的量n=$\frac{m}{M}$,而气体的摩尔质量相等,所以物质的量相等;相同温度、压强下X、Y的气体物质的量相同,所以X与Y的体积相同;
A.X、Y气体的密度相等,而气体的摩尔质量M=ρ×Vm,所以气体的摩尔质量相等,即相对分子质量相等,故A正确;
B.气体的物质的量n=$\frac{m}{M}$,而气体的摩尔质量相等,所以物质的量相等,故B正确;
C.分析可知相同温度、压强下X、Y的气体,其物质的量相同,所以X与Y气体的体积相同,故C正确;
D.气体的物质的量n=$\frac{m}{M}$,而气体的摩尔质量相等,所以物质的量相等,即n(X)=n(Y),H2的摩尔质量最小,所以n(H2)最大,即n(X)=n(Y)<n(H2),故D错误.
故选D.
点评 本题考查阿伏伽德罗定律及其推论,明确相同条件下密度与摩尔质量的关系是解本题关键,正确理解阿伏伽德罗定律及其推论,题目难度中等,侧重于考查学生的分析能力.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:实验题
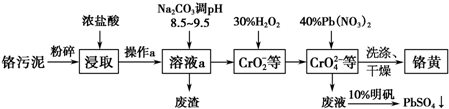
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、C1-、Mg2+、SO42- | B. | A13+、Cu2+、SO42-、C1- | ||
| C. | Ba2+、K+、NO3-、OH- | D. | Ca2+、Na+、C1-、A1O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④⑤ | C. | ②③④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
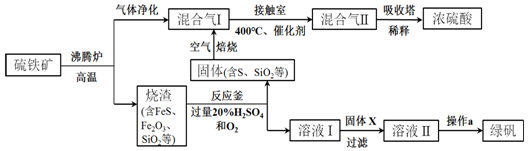
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 它的一氯代物只有一种同分异构体 | |
| B. | 它的二氯代物有两种同分异构体 | |
| C. | 它的分子式为C8H8 | |
| D. | 它与苯乙烯(C6H5-CH=CH2)互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2p1>p2 | B. | PCl5的分解率增大 | ||
| C. | p1>p2 | D. | Cl2的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
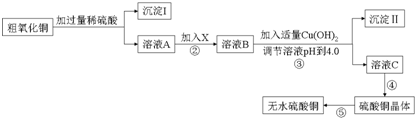
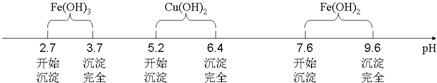
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com