

分析 (1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),
②2NO(g)+Cl2(g)?2ClNO(g),
根据盖斯定律①×2-②可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数为①的平衡常数平方与②的商;
(2)测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,由方程式计算参加反应NO物质的量,进而计算NO的转化率;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动;
(3)①若NO分解为放热反应,升高平衡向逆反应方向移动,NO分解率会降低;
在$\frac{n(NO)}{n(CO)}$=1的条件下,控制的最佳温度应是NO还原为N2的转化率最大温度;
②NO2-的水解常数K=$\frac{c(HN{O}_{2})×c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$,据此计算混合溶液中c(NO2-)和c(HNO2)的比值;
(4)阳极发生氧化反应,阳极上是二氧化硫被氧化为硫酸根;
阴极排出的溶液为S2O42-,与二氧化氮发生转化为无害气体,同时有SO42-生成,无害气体为氮气;
(5)①.温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应;
②.催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同;
(6)计算浓度积Qc=c(Ba2+)×c(SO32-),与溶度积Ksp(BaSO3)比较判断.
解答 解:(1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),
②2NO(g)+Cl2(g)?2ClNO(g),
根据盖斯定律①×2-②可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$,
故答案为:$\frac{{{K}_{1}}^{2}}{{K}_{2}}$;
(2)测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,由方程式可知参加反应NO物质的量为0.15mol,则NO的转化率为$\frac{0.15mol}{0.2mol}$×100%=75%;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α2>α1,
故答案为:75%;>;
(3)①升高温度,发现NO的分解率降低,可能是NO的分解反应是放热反应,升温有利于反应逆向进行,
由图可知,在$\frac{n(NO)}{n(CO)}$=1的条件下,870℃时NO还原为N2的转化率接近为100%,故最佳温度为870℃,
故答案为:NO的分解反应是放热反应,升温有利于反应逆向进行;870℃;
②常温下某NaNO2和 HNO2 混合溶液的PH为5,则溶液中c(OH-)=10-9mol/L,NO2-的水解常数K=$\frac{c(HN{O}_{2})×c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$=2×10-11mol•L-1,则混合溶液中c(NO2-)和c(HNO2)的比值为$\frac{c(O{H}^{-})}{2×1{0}^{-11}}$=50,
故答案为:50;
(4)阳极发生氧化反应,阳极上是二氧化硫被氧化为硫酸根,阳极电极反应式为:SO2+2H2O-2e-=SO42-+4H+;
阴极排出的溶液为S2O42-,与二氧化氮发生转化为无害气体,同时有SO42-生成,无害气体为氮气,反应离子方程式为:4S2O42-+6NO2+8OH-═8SO42-+3N2+4H2O,
故答案为:SO2+2H2O-2e-=SO42-+4H+;4S2O42-+6NO2+8OH-═8SO42-+3N2+4H2O;
(5)①.温度T2到达平衡的时间短,反应速率快,故温度T2>T1,温度越高,平衡时NO的浓度越高,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
②.催化剂的表面积S1>S2,则催化剂S1到达平衡的时间比催化剂S2短,催化剂不影响平衡移动,平衡时NO的浓度相同,故c(NO) 在T1、S2条件下达到平衡过程中的变化曲线为: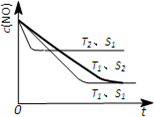 ,故答案为:
,故答案为: ;
;
(6)若溶液中c(Ba2+)=0.1 mol•L-1,c(SO32-)=6.3×10-8mol•L-1,其浓度积Q=c(Ba2+)×c(SO32-)=0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7,故不能析出BaSO3沉淀,
故答案为:不能;若溶液中c(Ba2+)=0.1 mol•L-1,c(SO32-)=6,3×10-8mol•L-1,其浓度积Q=c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7.
点评 本题考查化学平衡计算与影响因素、化学平衡常数、水解常数、电解原理应用、溶度积应用等,侧重考查学生分析计算能力,需要学生具备扎实的基础与灵活应用能力,难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 使用分液漏斗和容量瓶时,首先要查漏 | |
| B. | 蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体暴沸 | |
| C. | 向试管中加液体时,胶头滴管紧贴试管内壁 | |
| D. | 用蒸发皿进行加热蒸发时,一定要垫石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 先通二氧化碳、后通氨气、效果相同 | B. | 生成1mol(NH4)2SO4至少消耗2molNH3 | ||
| C. | CO2可被循环使用 | D. | 往甲中通CO2有利于制备(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:
(1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M<N | B. | 2M=N | C. | N<M | D. | M=N |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com