
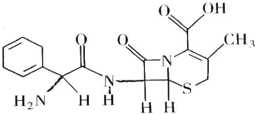
 头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )
头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )| A. | 分子式为C16H20N3O4S | |
| B. | 该物质在一定条件下能发生水解 | |
| C. | 该有机物质属于芳香族化合物 | |
| D. | 该物质不能与NaHCO3溶液反应放出CO2 |
科目:高中化学 来源: 题型:选择题
| A. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA个 | |
| B. | 电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g | |
| C. | 在反应3Cl2+8NH3═6NH4Cl+N2中,有1.2NA个电子发生转移,则被氧化的氨气的质量是27.2 g | |
| D. | 等物质的量的CH4和CO所含分子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应4FeS2+11O2=2Fe2O3+8SO2中,每生成1molSO2转移电子数为5.5NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| C. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| D. | 50g46%的乙醇水溶液中,含氢原子总数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
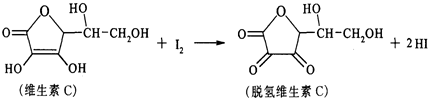
| A. | 上述反应为 取代反应 | |
| B. | 维生素C在酸性条件下水解只得到1种产物 | |
| C. | 滴定时可用淀粉溶液作指示剂 | |
| D. | 维生素C的分子式为C6H10O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
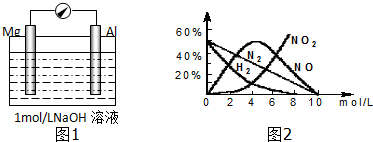
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ①④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入Ne | B. | 通入NO2 | C. | 通入N2O4 | D. | 以上都不行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
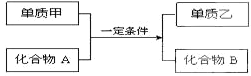
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com