
(12分)1.2003年底,重庆发生井喷毒气伤人事件,这主要是混杂在 中的H2S、______等有毒气体使人中毒。检测H2S可用 试纸。
2.硫和氧都是ⅥA族的元素,硫化氢中的一个H可以被乙基替代,得到乙硫醇,其化学式为 。其同系物异丙硫醇的化学式分别是 。
3.类似地,如果丙酮中的O被S替代,得到CH3-CS-CH3,则其命名为 ;同样,已知CH3-CO-SH命名为乙硫羟酸,则CH3-CS-OH可命名为 。
4.苯硫酚的酸性比苯酚 。
5.1mol化合物HSCH2CH(NH2)COOH能与 mol的NaOH反应。
6.HSCH2CH(NH2)COOH电离常数分别Ka1、Ka2、Ka3(Ka1>Ka2>Ka3),指出Ka1、Ka2、Ka3相对应的基团各是哪个?
 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
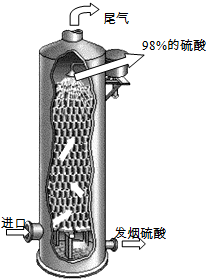 (2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸.
(2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸.| 成分 | 催化氧化前 | 催化氧化后 |
| O2 | 11% | 未测定 |
| SO2 | 7% | 未测定 |
| N2 | 82% | 84.8% |
| SO3 | -- | 6.9% |
| 800Q |
| a |
| 800Q |
| a |
查看答案和解析>>
科目:高中化学 来源:山东省高青县第二中学2009-2010学年高二上学期期末(模块)检测化学试卷(理) 题型:058
某同学为了测定其家中洗发液的酸碱性,该同学从学校借了部分化学仪器和药品后,在家做了如下实验:将一定体积的洗发液加入一定体积的蒸馏水中,充分搅拌后,洗发液充分溶解,测溶液的pH后向溶液中滴加食醋,每加入2 mL食醋就搅拌均匀,并测量溶液的pH,所得实验记录如下:
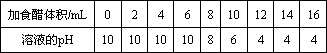
利用上述记录的数据,以加入食醋的体积为横坐标、溶液的
pH为纵坐标绘制曲线图,并根据曲线图回答下列问题:
(1)该同学家的洗发液的酸碱性如何?
(2)所用食醋的pH及c(H+)分别是多少(不必计算)?
(3)为使该溶液呈中性,所加入食醋的恰当体积是多少(不必计算)?
查看答案和解析>>
科目:高中化学 来源: 题型:
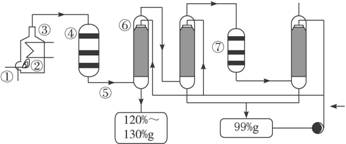
图1-1
(1)在①处投入的液态原料是什么?_______________________
(2)在②处发生1 500 ℃的不完全燃烧,即先混入少量的干燥空气,然后再在③处于700 ℃下再发生继续燃烧。为何这种燃烧方式对环境保护是有利的?_______________________
(3)在④处SO2被催化氧化成SO3,为使SO3的产率高,该处应取等温过程还是绝热过程为宜?_____________________________________________________________________
(4)为何二次催化炉⑦是必需的?_______________________
(5)⑤处的气体混合物主要是N2和SO3,为什么气体混合物通过吸收塔⑥后不立即通入二次催化炉?
_____________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸。
| 成分 | 催化氧化前 | 催化氧化后 |
| O2 | 11% | 未测定 |
| SO2 | 7% | 未测定 |
| N2 | 82% | 84.8% |
| SO3 | —— | 6.9% |
⑴SO2的催化氧化是硫酸工业的主要反应。现有标准状态下5.6 L SO2气体,在500℃、V2O5催化下转化成SO3,若SO2转化率为a%,放出热量为QkJ。该反应的热化学方程式为 ▲ 。
⑵已知在SO2催化氧化前后混合气体中各成分的体积分数如表,
则SO2的转化率为 ▲ 。
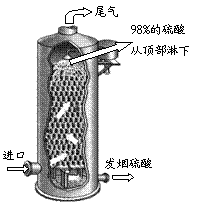 ⑶如右图所示,用98%的浓硫酸1.0t吸收SO3制得发烟硫酸(化学组成可表示为H2SO4·xSO3),可生产SO3质量分数为20%的发烟硫酸 ▲ t。
⑶如右图所示,用98%的浓硫酸1.0t吸收SO3制得发烟硫酸(化学组成可表示为H2SO4·xSO3),可生产SO3质量分数为20%的发烟硫酸 ▲ t。
⑷某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品充分灼烧,生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,再用0.02000 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则样品中FeS2的质量分数是多少?(假设杂质不参加反应)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com