
温度为500℃时,反应4NH3+5O2 4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
A.v(NO)=0.08mol/(L?s) B.v(O2)=0.01mol/(L?s)
C.v(NH3)=0.002mol/(L?s) D.v(H2O)=0.004mol/(L?s)
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
资料显示不同浓度的硫酸与锌反应时,
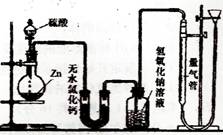 硫酸可以被还原为SO2,也可被还原为氢气。为
硫酸可以被还原为SO2,也可被还原为氢气。为
了验证这一事实,某同学拟用下图装置进行实验
(实验时压强为10lkPa,温度为0℃)。
(1)若在烧瓶放入1.30g锌粒,与c mol/L H2SO4
反应,为保证实验结论的可靠,在洗气瓶中
加入1mol/L NaOH溶液的体积V≥_______mL,
量气管的适宜规格是_____________mL。 (选填:200,400,500)。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则发生反立的化学方程式
为:________________________________________
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集裂VmL气体,则有:ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是;
____________________________________________________________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用如图K16-2所示装置进行实验(实验时压强为101 kPa,温度为0 ℃)。

图K16-2
(1)若在烧瓶中放入1.30 g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是________________________________________。
A.200 mL B.400 mL C.500 mL
(2)若1.30 g锌粒完全溶解,氢氧化钠洗气瓶增重1.28 g,则圆底烧瓶中发生反应的化学方程式为______________________________________。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气瓶中收集到V mL气体,则有:a g÷65 g·mol-1=b g÷64 g·mol-1+V mL/22400 mL·mol-1,依据的原理是___________________________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重m g,则整个实验过程产生的气体中,n(H2)/n(SO2)=______________________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U形管,n(H2)/n(SO2)的数值将________(填“偏大”“偏小”或“无影响”)。
(5)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
①________________________________________________________;
②________________________________________________________;
③____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省肇庆市高三上学期期末质量检测理综化学试卷(解析版) 题型:填空题
化工行业的发展必须符合国家节能减排的总体要求。请回答下列问题:
(1)已知C(s)+H2O(g)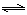 CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。
(2)已知在一定温度下,
C(s)+CO2(g)
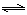 2CO(g)
△H1
2CO(g)
△H1
CO(g)+H2O(g)
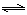 H2(g)+CO2(g)
△H2
H2(g)+CO2(g)
△H2
C(s)+H2O(g)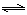 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
则△H1、△H2、△H3之间的关系是: 。
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g) 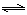 H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
则该反应的正反应方向是 反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g) 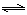 2NO2(g)
△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
2NO2(g)
△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
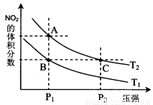
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用下图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为: ,阳极区逸出气体的成分为 (填化学式)。
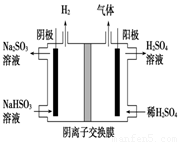
查看答案和解析>>
科目:高中化学 来源:2010年河北省高三上学期第一次月考化学试题 题型:实验题
(16分)资料显示不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
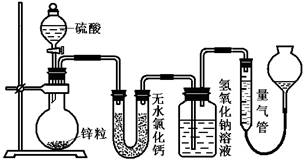
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ (选填:200,400,500) mL 。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:________________________________________
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到 VmL气体,则有:ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。
(5) 反应结束后,为了准确地测量气体体积,量气管在读数时应注意: 、 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com