
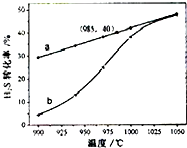
 H2S受热分解的反应为:2H2S(g)→2H2(g)+S2(g).在恒温密闭容器中,控制不同温度进行 H2S分解实验.以H2S起始浓度均为cmol?L-1测定H2S的转化率,结果如图.图中a曲线为H2S 的平衡转化率与温度关系,b曲线表示不同温度下反应经过相同时间的转化率.下列叙述错误的是( )
H2S受热分解的反应为:2H2S(g)→2H2(g)+S2(g).在恒温密闭容器中,控制不同温度进行 H2S分解实验.以H2S起始浓度均为cmol?L-1测定H2S的转化率,结果如图.图中a曲线为H2S 的平衡转化率与温度关系,b曲线表示不同温度下反应经过相同时间的转化率.下列叙述错误的是( )A、985℃时,H2S按上述反应分解的平衡常数K=
| ||
| B、H2S的分解为吸热反应 | ||
| C、图象能解释,温度升高,反应速率加快 | ||
| D、如果只将上述条件中的温度改为压强,图象的形式基本不变 |
| 0.2c×(0.4c)2 |
| (0.6c)2 |
| 0.8c |
| 9 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
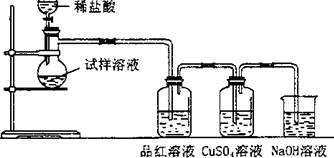 无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装置进行实验,他向试样溶液中缓缓地逐滴加入稀盐酸,根据实验现象判断固体试样含有什么成分?(已知:Na2 S+2HCl═2NaCl+H2S+SO2+2H2S═3S+2H2 O)
无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装置进行实验,他向试样溶液中缓缓地逐滴加入稀盐酸,根据实验现象判断固体试样含有什么成分?(已知:Na2 S+2HCl═2NaCl+H2S+SO2+2H2S═3S+2H2 O)查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:| 装置 | A (试管+粉末) |
B | C |
| 反应前 | 42.0g | 75.0g | 140.0g |
| 反应后 | 37.0g | 79.0g | 140.5g |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
取2.5克KClO3粉末置于冰水冷却的锥形瓶中,加入5.0克研细的I2,再注入3cm3水,在45分钟内不断振荡,分批加入9~10cm3浓HCl,直到I2完全消失为止(整个反应过程保持在40℃以下)。将锥形瓶置于冰水中冷却,得到橙黄色的晶体A。
将少量A置于室温下的干燥的试管中,发现A有升华现象,用湿润的KI-淀粉试纸在管口检测,试纸变蓝.接着把试管置于热水浴中,有黄绿色的气体生成,管内的固体逐渐变成红棕色液体。
将少量A分别和KI,Na2S2O3,H2S等溶液反应,均首先生成I2。
酸性的KMnO4可将A氧化,得到的反应产物是无色的溶液。
(1)写出A的化学式;写出上述制备A的配平的化学方程式。
(2)写出A受热分解的化学方程式。
(3)写出A和KI反应的化学方程式。
附:原子量 K 39.10;Cl 35.45;I 126.9;O 16.00
查看答案和解析>>
科目:高中化学 来源:期末题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com