
����Ŀ��������������Ҫ��Ni������Al��Fe��SiO2�������������ᡢ������ʡ����÷��������Ʊ�NiSO4��7H2O���壬��������ͼ��
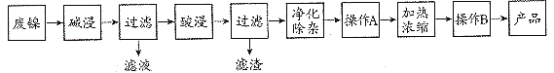
��֪��Ksp[Fe(OH)3]=8.0��10��38��Ksp[Fe(OH)2]=8.0��10��16��Ksp[Al(OH)3]=3.2��10��34��Ksp[Ni(OH)2]=2.0��10��15��1g2=0.3��
�ش���������
��1�������ʱ���������ӷ���ʽΪFe+2H+=Fe2++H2����____��
��2��������������Ҫ�ȼ���H2O2��Һ��������Ӧ�����ӷ���ʽΪ___��
��3��Ni2+��ǿ������Һ�л��ɱ�NaClO����ΪNiOOH���÷�Ӧ���ӷ���ʽΪ___��
���𰸡�Ni+2H+=Ni2++H2����OH-+H+=H2O H2O2+2Fe2++2H+=2Fe3++2H2O 2Ni2++4OH-+ClO-=2NiOOH��+Cl-+H2O
��������
���������Ʊ�NiSO47H2O���������Ϊ�����������ȼ����Al��SiO2������Ӧ��Ni��Fe�������������ᡢ������ʲ���Ӧ�����˳�ȥ��Һ�õ�����Ni��Fe���������ʣ���������ܽ�������Ŀ���ǵõ�NiSO47H2O���������������µ����ʣ�Ӧ��Ϊ���ᣬ��������Ϊ�������������ʣ���Һ�к���Ni2+��SO42-��Fe2+��������������Ҫ�ȼ���H2O2��Һ������������˫��ˮ��������Fe2(SO4)3��������ӦΪ2Fe2++H2O2+2H+=2Fe3++2H2O��������ҺpHʹ������ת������������������ͨ������A���˳�ȥ����������NiSO4��Һ����NiSO4��Һ����Ũ������ȴ�ᾧ�����˵õ�NiSO47H2O���壬�ݴ˽��
(1)�����ʱ���������ֱ��������NaOH��Fe��Ni������Ӧ�����������ӷ���ʽ�ֱ�ΪOH+H+=H2O��Fe+2H+=Fe2++H2����Ni+2H+=Ni2++H2����
(2)���������������H2O2��Һ����Ŀ����������Fe2+ΪFe3+��Fe3+�����γ�Fe(OH)3�Ӷ��ﵽȥ��FeԪ�ص�Ŀ�ģ�������ӦΪ��2Fe2++H2O2+2H+=2Fe3++2H2O��
(3)NiSO4��ǿ������Һ�пɱ�NaClO����ΪNiOOH��ClO����ԭΪCl�����ݵ����غ���ƽ�÷�Ӧ�����ӷ���ʽӦΪ��2Ni2++ClO+4OH=2NiOOH��+Cl+H2O��


 ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ȼ�ѧ����ʽ����������ȷ����( )
A.������ȼ����Ϊ285.5 kJmol-1,��ˮ�����Ȼ�ѧ����ʽΪ:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g) ![]() H=+285.8kJmol-1
H=+285.8kJmol-1
B.1mol������ȫȼ������CO2 (g)��H2O(l)ʱ�ų�890kJ����,�����Ȼ�ѧ����ʽΪ 1/2CH4(g)+O2(g) ![]() 1/2CO2(g)+H2O(l)
1/2CO2(g)+H2O(l) ![]() H=-445kJmol-1
H=-445kJmol-1
C.��֪2C(s)+O2(g) ![]() 2CO(g)
2CO(g) ![]() H=-221kJmol-1,��C��ȼ����Ϊ110.5 kJmol-1
H=-221kJmol-1,��C��ȼ����Ϊ110.5 kJmol-1
D.HF��NaOH��Һ��Ӧ:H+(aq)+OH-(aq) = H2O(l) ![]() H=-57.3kJmol-1
H=-57.3kJmol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(![]() )����һ�ָ�Ч�������������ɱ��������������Ũ������������Ƶã�ʵ��װ�úͲ������£�
)����һ�ָ�Ч�������������ɱ��������������Ũ������������Ƶã�ʵ��װ�úͲ������£�
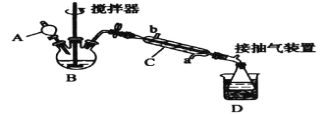
����������ƿ�м���һ������������Ũ����Ļ����ٻ�����������30%��˫��ˮ��
�ڲ��Ͻ��貢����װ��B�л��Һ���¶�Ϊ20��30������Ӧ������
�۽�������C�ͳ����ã�����ƿ���ռ��õ���Ʒ��
�ش��������⣺
��1������C��������____������C����ˮ�������____(����a������b��)��
��2��Ϊ���õؿ��Ʒ�Ӧ�¶ȣ�Ӧ���õļ��ȷ�����_____��
��3�����ɹ�������Ļ�ѧ����ʽΪ____��
��4��ʵ���ò����������İٷֺ����淴Ӧ������ͷ�Ӧʱ��ı仯�������±����ɱ������ݿ�֪����Ӧ����ѱ���(CH3COOH/H2O2)��_____����ѷ�Ӧʱ��Լ_____��
��Ӧ�����CH3COOH/H2O2 | ��Ӧʱ�� | ||||
0.5h | 1h | 3h | 5h | 7h | |
2��1 | 7.38% | 8.46% | 9.42% | 11.26% | 13.48% |
1��1 | 0.56% | 12.92% | 13.54% | 20.72% | 20.80% |
1��2 | 6.14% | 7.10% | 7.96% | 10.38% | 12.36% |
��5����Ʒ�й�������Ũ�ȵIJⶨ��ȡ2.00mL���������Ʒ��������ˮϡ�ͳ�100mL������ȡ��5.00mL����εμ�����KMnO4��Һ����Һǡ�óʷۺ�ɫ���Գ�ȥ�����H2O2���ټ����Թ�����KI��Һ��������ӦCH3COOOH��2I-��2H+=I2��CH3COOH��H2O����Ӧ��ȫ���뼸�ε�����Һ����0.1000mol��L-1��Na2S2O3��Һ�ζ����յ�(��ӦʽΪ2S2O32-��I2=S4O62-��2I-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����·�Ӧ���ɻ�ȡH2�������й�˵����ȷ����
��̫������ֽ�ˮ���⣺2H2O(l)��2H2(g)+O2(g) ��H1=+571.6kJmol��1
�ڽ�̿��ˮ��Ӧ���⣺C(s)+H2O(g)��CO(g)+H2(g) ��H2=+131.3kJmol��1
�ۼ�����ˮ��Ӧ���⣺CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ��H3=+206.1kJmol��1��
CO(g)+3H2(g) ��H3=+206.1kJmol��1��
A. ��ӦCH4��g���� C(s)+2 H2(g)����H=+74.8kJmol��1 ��
B. ���ˮҲ����ȡ���������������ұȷ����ٸ����㣬�����ܡ�
C. ��Ӧ��ÿ����2g������Ҫ����131.3kJ�����������Ը÷�Ӧû��Ӧ�ü�ֵ��
D. ��Ӧ���У�������1mol�ļ�����ˮ������ϣ�Ҫ����206.1kJ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�pH=1��ij��Һ�л����� Na+��Fe3+��Fe2+��I-��Cl-��CO32-�е������֣���ȡ100mL ����Һ����ʵ��(������ʵ�����������������������ʧ��������Һ����仯)���������Һ��ͨ�������������ַ�Ӧ�����CCl4������ȡ��Һ���õ�ˮ�����ɫ�л��㣻����ʵ��ٵõ���ˮ�㣬����������NaOH��Һ���������������ˣ��õ��ij�������ϴ�ӡ����պ�õ�1.60g���壻����ʵ���������Һ�м�����������Һ��ϡ���ᣬ������ɫ����������ʵ������õ�����ɫ�л��㣬����һϵ�в����õ�2.54g�Ϻ�ɫ���塣����ʵ�����������ж���ȷ����
A.����ȷ��Na+��Cl-�Ƿ���ڣ�CO32-һ��������
B.Fe2+��I-��Cl-��������һ������
C.Fe3+��Fe2+������һ��
D.����Һ��c(Cl-)��0.1mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ�������Ҫ�ɷ�ΪPbS�������������ַ�����Ǧ������ұ������Ǧ��
I.����Ǧ��Ǧ�����ڿ����б��գ�����PbO��SO2��
(1) ��Ǧ�������Ǧ�ķ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ_________��
(2) ����Ǧ�ķ����к���Ũ��SO2���ɽ�����ͨ�������ˮ�н��д�������Ӧ�����ӷ���ʽΪ��__________��
II.ʪ����Ǧ���Ʊ�����Ǧ��ͬʱ�������Ƶ���ǣ�����ڻ���Ǧ��Ϊ������ʪ����Ǧ�Ĺ����������£�

��֪��PbCl2��ˮ���ܽ��С����Cl��Ũ�Ƚϴ����Һ�У�����ƽ�⣺PbCl2(s) + 2Cl��(aq)PbCl42��(aq) H��0
(3) ��ȡǦ����ʱ������Ӧ�����ӷ���ʽ��________��
(4) ����Һ1������ PbCl2�IJ���a��_______��
(5) ����Һ3����Һ2�ֱ�������ͼ��ʾ���װ�õ����������У�����ȡ����Ǧ��ʹ��ȡҺ�е�FeCl3������

����Һ3Ӧ����______(������������������������)�С�
�ڼ�����Һ2��������ΪFeCl3�Ŀ���ԭ����_________
����Ǧ���������Ϊa g��Ǧ������Ϊb ����������ͨ��c mol����ʱ������Ǧȫ��������Ǧ������PbS�����������ļ���ʽΪ____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019�꡶��ѧ�������ڿ����濯����ͼ��ʾ���л���M(ֻ��C��H��O)�����ģ��ͼ����ͬ��С����ɫ��С�������ͬ��ԭ�ӣ�С��֮�����������ʾ���ۼ����ȿ��Ա�ʾ������Ҳ���Ա�ʾ˫���������Ա�ʾ�����������й�M���ƶ���ȷ����
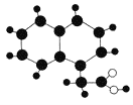
A.M�ķ���ʽΪC12H12O2
B.M������������һ�������·�Ӧ�IJ���Ļ���һ�ȴ�����7��
C.M�ܷ����кͷ�Ӧ��ȡ����Ӧ���ӳɷ�Ӧ
D.һ��M���������11��ԭ�ӹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��mA(g)+nB(g)![]() pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C����������Ҳ��С����:
pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C����������Ҳ��С����:
��1�� m+n_________p(����������=��������)��
��2������ѹʱ��A����������_________��(��������������С����������������ͬ)
��3��������A(�������)����B��ת����_________��
��4���������¶ȣ���ƽ��ʱB��C��Ũ��֮��![]() ��_________��
��_________��
��5�������������ƽ��ʱ��������������ʵ���___________��
��6����B����ɫ���ʣ�A��C����ɫ��ά��������ѹǿ���䣬��������ʱ���������ɫ_______(��������������dz������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���4molA��3molB�������Ϊ1L���ܱ������У��������·�Ӧ��aA(g)+2B(g)![]() 3C(g)+D(g)����Ӧ�ﵽƽ���C��Ũ��Ϊ3mol/L��ѹ�����������ʹ�����������Сһ�룬�����µ�ƽ��ʱ��B��Ũ��Ϊ2mol/L����ʽ��a����ֵΪ
3C(g)+D(g)����Ӧ�ﵽƽ���C��Ũ��Ϊ3mol/L��ѹ�����������ʹ�����������Сһ�룬�����µ�ƽ��ʱ��B��Ũ��Ϊ2mol/L����ʽ��a����ֵΪ
A. 1 B. 2 C. 3 D. 4
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com