
为了测定m g氢氧化钠和碳酸钠的固体混合物中碳酸钠的质量分数,甲、乙两位同学分别设计了如下的实验方案:
(1)甲同学的方案是:将样品溶解,加入过量氯化钡溶液,过滤、洗涤,取沉淀烘干,称量得固体ng.则混合物中碳酸钠的质量分数为________;
(2)乙同学的方案是:将样品溶解后,加入稍过量的氯化钡溶液,再滴入2-3滴酚酞试液,用标准盐酸滴定.乙同学在滴定过程中所需要的主要玻璃仪器有________、________.加入过量氯化钡溶液的目的是________.
(3)丙同学的方案如下图所示
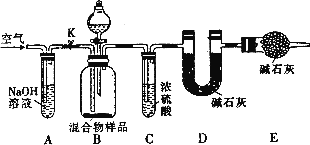
当混合物样品完全反应时,缓慢通入空气的目的是________,其中,装置A的作用是________,装置E的作用________.
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 0.14CV |
| m |
| 14CV |
| m |
| 0.14CV |
| m |
| 14CV |
| m |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
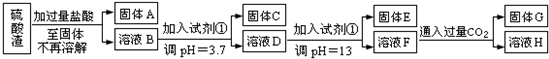
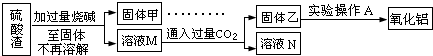
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.甲同学的方案如下图所示:
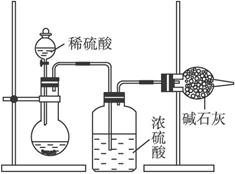
(1)根据甲同学的实验装置图分析,在每次实验过程中所进行的称量操作至少要进行_________次。
(2)甲同学重复测定了三次,得到碳酸钠的质量分数的数据存在较大的偏差,你认为原因可能是_________(填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
D.加入稀硫酸的量不足,则可能造成误差
Ⅱ.乙同学的方案是:称取样品m g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称量得固体n g。
(1)混合物中碳酸钠的质量分数为(用m、n表示) ___________________________。
(2)洗涤沉淀的操作要点是___________________________。
(3)Ca2+、Ba2+都可以使![]() 沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是___________________________;测定
沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是___________________________;测定![]() 的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是___________________________。
的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是___________________________。
查看答案和解析>>
科目:高中化学 来源:淄博二模 题型:问答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com