
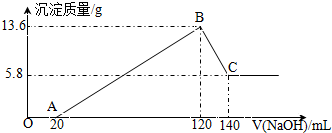
 ��һ��������Mg-Al�Ͻ�Ͷ��100mLһ�����ʵ���Ũ�ȵ�ijHCl��Һ�У���ַ�Ӧ����Ӧ�����Һ����μ���һ�����ʵ���Ũ�ȵ�NaOH��Һ�����ɳ���������������NaOH��Һ�������ϵ��ͼ���ش��������⣺
��һ��������Mg-Al�Ͻ�Ͷ��100mLһ�����ʵ���Ũ�ȵ�ijHCl��Һ�У���ַ�Ӧ����Ӧ�����Һ����μ���һ�����ʵ���Ũ�ȵ�NaOH��Һ�����ɳ���������������NaOH��Һ�������ϵ��ͼ���ش��������⣺| n |
| V |
| 7.8g |
| 78g/mol |
| 0.1mol |
| 0.02L |
| 0.6mol |
| 0.1L |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
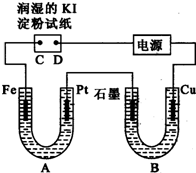 ���װ����ͼ��ʾ��ͼ��Bװ��ʢ1L 3mol?L-1 K2SO4��Һ��Aװ����ʢ1L 3mol?L-1 AgNO3��Һ��ͨ��һ��ʱ�����ʪ�ĵ���KI��ֽ��C�˱���ɫ���Իش�
���װ����ͼ��ʾ��ͼ��Bװ��ʢ1L 3mol?L-1 K2SO4��Һ��Aװ����ʢ1L 3mol?L-1 AgNO3��Һ��ͨ��һ��ʱ�����ʪ�ĵ���KI��ֽ��C�˱���ɫ���Իش�| ������ | �״� | ��������� | |
| �۵�/�� | 122.4 | -97 | -12.3 |
| �е�/�� | 249 | 64.3 | 199.6 |
| �ܶ�/g?cm-3 | 1.2659 | 0.792 | 1.0888 |
| ˮ���� | �� | ���� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� Ԫ�� | A | B | C | D | E | F | G | H | I | J |
| ԭ�Ӱ뾶��10-10m�� | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| ���̬ | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| ��ͼ�̬ | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
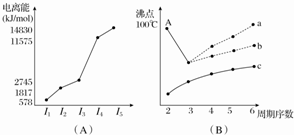
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
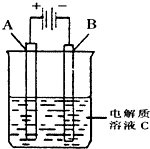 �£�N2H4���ֳ���������һ�ֿ�ȼ��Һ�壬��ȼ���Ƚϴ���ȼ�ղ���Ի�������Ⱦ���ʿ����������ȼ�ϣ�
�£�N2H4���ֳ���������һ�ֿ�ȼ��Һ�壬��ȼ���Ƚϴ���ȼ�ղ���Ի�������Ⱦ���ʿ����������ȼ�ϣ��鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com