
| A.92>Ql>2Q2 | B.92=Q1<2Q2 | C.Q1=2Q2=92 | D.Q1=2Q2<92 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:计算题
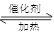 2SO3(g),2min末测得容器中有7.2mol SO2。试回答:
2SO3(g),2min末测得容器中有7.2mol SO2。试回答: B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 3 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
 B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2HI(g)达到平衡状态的是 ( )
2HI(g)达到平衡状态的是 ( )| A.混合气体的压强恒定不变 | B.混合气体的密度不再改变 |
| C.H2、I2、HI的浓度相等 | D.I2在混合气体中的体积分数不再改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2O(g)
CO(g)+H2O(g)

| A.容器压强不变 | B.混合气体中c(CO2)不变 | C.υ正(H2)=υ逆(H2O) | D.c(CO2)=c(CO) |
 CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.0 kJ·mol-1 
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
 2NO(g)达到平衡时NO的浓度 。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度 。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4HCl+Si
4HCl+Si| A.反应制得的硅可用于制造半导体材料 |
| B.增大压强有利于加快上述反应的化学反应速率 |
| C.四氯化硅可以由粗硅与氯气通过化合反应制得 |
| D.混入少量空气对上述反应无影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| t / s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3) mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xC(g) + yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知v(B) : v(C)="3" : 2,则下列说法中正确的是
xC(g) + yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知v(B) : v(C)="3" : 2,则下列说法中正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.30%和H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂 |
| B.SO2和CO2都属于酸性氧化物,Na2O和Al2O3都属于碱性氧化物[ |
| C.在NH4Cl水溶液中,既存在水解平衡,又存在电离平衡 |
| D.O2在放电条件下生成O3属于化学变化,煤干馏得到焦炭属于物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com