
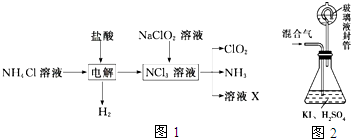
分析 (1)KClO3在H2SO4存在下与Na2SO3反应,SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O;
(2)由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑,在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,X中含Cl-、OH-;由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体,利用性质差异分离提纯;
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水;
②玻璃液封装置可防止有害气体逸出;
③淀粉遇碘单质变蓝;
④根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2);
(4)亚氯酸盐具有氧化性,Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子.
解答 解:(1)KClO3在H2SO4存在下与Na2SO3反应制得ClO2,可知SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O,氧化剂为KClO3,还原剂为Na2SO3,由离子反应可知该反应氧化剂与还原剂物质的量之比为2:1,
故答案为:2:1.
(2)①由生产流程可知氯化铵在盐酸溶液中电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑,
故答案为:NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑.
②在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,发生NCl3+NaClO2+H2O→ClO2+NH3+NaOH+NaCl,溶液X中大量存在的阴离子有Cl-、OH-,
故答案为:Cl-、OH-.
③a.ClO2易溶于水,不能利用饱和食盐水吸收氨气,故错误;
b.碱石灰不能吸收氨气,故错误;
c.浓硫酸可以吸收氨气,且不影响ClO2,故正确;
d.ClO2易溶于水,不能利用水吸收氨,故错误;
故答案为:c.
(3)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+═2Cl-+5I2+4H2O,
故答案为:2ClO2+10I-+8H+═2Cl-+5I2+4H2O.
②玻璃液封装置的作用是吸收残留的ClO2气体(避免碘的逸出),故答案为:吸收残留的ClO2气体(避免碘的逸出).
③V中加入的指示剂通常为淀粉溶液,滴定至终点的现象是溶液由蓝色变为无色,且半分钟内不变色,
故答案为:淀粉溶液,溶液由蓝色变为无色,且半分钟内不变色.
④含有Na2S2O3物质的量为0.02 L×0.1mol/L=0.002 mol,则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) 0.002mol
所以n(ClO2)=0.0004mol,
所以m(ClO2)=0.004 mol×67.5g/mol=0.02700g,
故答案为:0.02700;
(4)若要除去超标的亚氯酸盐,ac均不能还原亚氯酸盐,b中KI具有还原性但氧化产物不适合饮用水使用,只有d中Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子,且铁离子水解生成胶体可净化饮用水,则最适宜的是d,
故答案为:d.
点评 本题考查物质含量的测定,为高频考点,为2015年高考真题,把握物质的性质、制备流程、发生的反应为解答的关键,侧重分析与实验、计算能力的综合考查,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

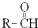 +
+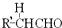 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$ (-R、-R’表示氢原子或烃基)用B和C为原料按如下路线合成A:
(-R、-R’表示氢原子或烃基)用B和C为原料按如下路线合成A: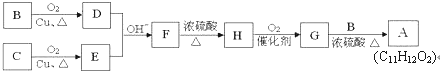
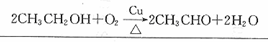
 .
.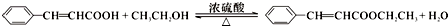
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaFeO4 | B. | Na2FeO4 | C. | NaFe2O4 | D. | Na2Fe3O8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体与硅酸胶体(硅酸胶体微粒带负电荷)混合将产生聚沉现象 | |
| B. | Fe(OH)3胶体粒子在电场影响下将向正极运动 | |
| C. | Fe(OH)3胶体粒子不停地做布朗运动 | |
| D. | 光线通过Fe(OH)3胶体时会产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米铜能在氧气中燃烧,说明了纳米铜比普通铜的还原性强 | |
| B. | 白色污染与塑料垃圾有关 | |
| C. | 臭氧空洞的形成与化石燃料大量使用有关 | |
| D. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| B. | 在铁制品上镀铜时,石墨为阳极,铁制品作阴极,铜盐为电镀液 | |
| C. | 用锡焊接的铁质器件,焊接处易生锈 | |
| D. | 燃气灶上的炒锅支架容易生锈,主要是由于高温下铁易发生“化学腐蚀” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素的化学式都是(C6H10O5)n,故互为同分异构体 | |
| B. | 不含杂质的天然油脂属于高分子化合物,有固定的熔、沸点 | |
| C. | 蔗糖、植物油、天然蛋白质完全燃烧后的最终产物均为C02和H20 | |
| D. | 纤维素乙酸酯、油脂、蛋白质和麦芽糖在一定条件下都能水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com