
【题目】下列判断正确的是( )
A.可用水来确定某氧化钠粉末中是否含有过氧化钠
B.可用二氧化碳来确定某氧化钠粉末中是否含有过氧化钠
C.可利用在空气中加热的方法除去氧化钠中的过氧化钠
D.将足量的过氧化钠、氧化钠分别加到酚酞溶液中,最终溶液均为红色
【答案】A
【解析】
A.氧化钠与水反应生成氢氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,向某氧化钠粉末中加入水,若产生无色无味的气体,则氧化钠粉末中含有过氧化钠,反之不含过氧化钠,A正确;
B.氧化钠与二氧化碳反应生成碳酸钠,过氧化钠与二氧化碳反应生成碳酸钠和氧气,由于CO2、O2都是无色无味的气体,无论氧化钠中是否含有过氧化钠,二氧化碳通过某氧化钠粉末都不能观察到明显实验现象,B错误;
C.在空气中加热会发生反应:2Na2O+O2![]() 2Na2O2,不能将过氧化钠除去,且消耗氧化钠,C错误;
2Na2O2,不能将过氧化钠除去,且消耗氧化钠,C错误;
D. 将足量的过氧化钠、氧化钠分别加到酚酞溶液中,两者与水反应都有NaOH生成,但过氧化钠又具有强氧化性,故前者的溶液先变红后褪色,后者的溶液最终变为红色,D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】I.某研究小组探究SO2和Fe(NO3)3溶液的反应。
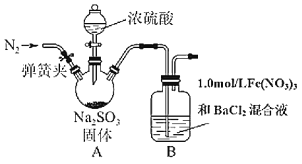
已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,铁架台等夹持仪器已略去,请回答:
(1)用于加入浓硫酸的仪器名称为 ________。装置A中发生的化学方程式为______。
(2)滴加浓硫酸之前要先打开弹簧夹通入一定量的N2,其目的是_____________。
(3)实验中,装置B中产生了白色沉淀,该沉淀的成分是_______,说明SO2具有______性。
(4)分析B中产生白色沉淀的原因:
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
基于观点1,装置B中反应的离子方程式___________。
为证明该观点,应进一步检验生成的新物质,其实验操作及现象为(假定在反应中SO2的量不足_________。
基于观点2,只需将装置B中Fe(NO3)3溶液替换为等体积的下列溶液,在相同的条件下进行实验。应选择的最佳试剂是 _________ (填序号)。
A.0.1 mol·L-1的稀硝酸 B. 1.5 mol·L-1的Fe(NO3)3溶液
C.6.0 mol·L-1的NaNO3和0.2 mol·L-1盐酸等体积混合的混合液
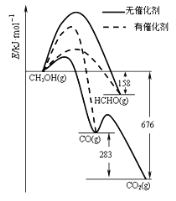
Ⅱ.人们常用催化剂来选择反应进行的方向。 图所示为一定条件下1 mol CH3OH与O2发生反应时生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成_____(填“CO” 、“CO2”或“HCHO”);2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
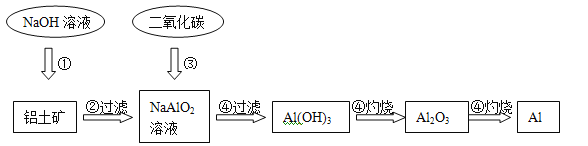
(1)请用离子方程式表示以上工艺流程中第①步反应:__ _______。
(2)写出以上工艺流程中第③步反应的化学方程式:_ _____。
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应。该反应的化学方程式_____________。请举一例该反应的用途_____________。
(4)电解熔融氧化铝制取金属铝,若有0.9mol电子发生转移.理论上能得到金属铝的质量是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |

下列说法正确的是( )
A. 用甲装置过滤时,需不断搅拌
B. 用乙装置将Br-氧化为Br2
C. 丙装置中用正十二烷而不用CCl4,是因为其密度小
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
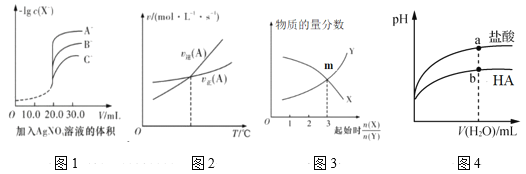
A.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均与Ag+反应生成沉淀),由图1可确定首先沉淀的是C-
B.图2表示反应中某反应物的正、逆反应速率随温度变化的情况, 由图可知该反应的正反应是吸热反应
C.图3表示一定条件下,X(g)![]() Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
Y(g)+Z(s)中物质的量分数随起始投料比变化。m点对应的X转化率为33.3%
D.图4表示常温下稀释pH相同的HA与盐酸时溶液pH与加入水体积的关系,则HA为弱酸,且a点Kw的数值比b点的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是
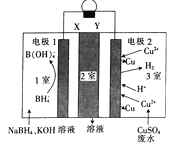
A. X、Y依次为阳离子、阴离子选择性交换膜
B. 负极的电极反应式:BH4-+8OH-一8e-═B(OH)4-+4H2O
C. 2室流出的溶液中溶质为Na2SO4和K2SO4
D. 电路中每转移1mol电子,电极2上有32gCu析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Y(乙酰氧基胡椒酚乙酸酯)具有抗氧化、抗肿瘤作用,可由化合物X在一定条件下合成:
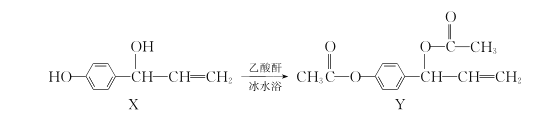
下列说法正确的是
A.Y中有3种不同官能团
B.X、Y分子中均含有的手性碳原子数不相同
C.1molX与溴水充分反应,最多消耗Br2的物质的量为2mol
D.1molY与NaOH溶液充分反应,最多消耗NaOH的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCO3可用作选矿剂、催化剂及家装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
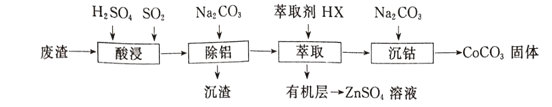
下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式____________________。
(2)“除铝”过程中需要调节溶液pH的范围为_______________ 。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是______。
(4)简述洗涤沉淀的操作____________________________________。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用一直是研究课题。某地天然海水(主要含Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子),研究用海水吸收燃煤排放的含有SO2烟气的工艺流程如图所示,下列说法中正确的是
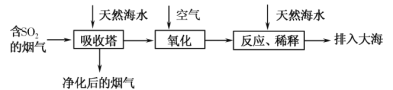
A.工艺中天然海水显酸性
B.氧化过程中可能发生的离子反应为2SO2+2H2O+O2=4H++2SO42-
C.排入大海的溶液与天然海水相比,只有SO42-数量发生了变化
D.若将氧化后的液体进行蒸发结晶,得到的晶体中CaSO4含量最高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com