
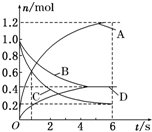
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 反应进行到1s时,v(A)=v(C) | |
| C. | 反应进行到6s时,B和D的物质的量浓度均为0.4mol•L-1 | |
| D. | 反应进行到6s时,B的平均反应速率为0.05mol/(L•s) |
分析 A.根据图象中的有关数据判断四种物质的变化,再根据计量数之比等于物质的量的变化量之比;
B.根据v=$\frac{\frac{△n}{V}}{△t}$进行计算反应进行到1s时v(A)、v(C);
C.反应进行到6s时,B、D的物质的量都是0.4mol,根据c=$\frac{n}{V}$计算B和D的物质的量浓度;
D.根据v=$\frac{\frac{△n}{V}}{△t}$进行计算反应进行到6s时B的平均反应速率.
解答 解:A.由图可知,反应达到平衡时A物质增加了1.2mol、D物质增加了0.4mol、B物质减少了0.6mol、C物质了0.8mol,所以A、D为生成物,物质的量之比为3:1,B、C为反应物,物质的量之比为3:4,反应方程式为:3B+4C?6A+2D,故A错误;
B.反应到1s时,v(A)=$\frac{\frac{0.6mol}{2L}}{1s}$=0.3mol/(L•s),v(D)=$\frac{\frac{0.2mol}{2L}}{1s}$=0.1mol/(L•s),则v(A)≠v(D),故B错误;
C.反应进行到6s时,B、D的物质的量都是0.4mol,在B、D的物质的量浓度为:$\frac{0.4mol}{2L}$=0.2mol/L,故C错误;
D.反应进行到6s时,v(B)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.6mol}{2L}}{6s}$=0.05mol/(L•s),故D正确;
故选D.
点评 本题考查了化学平衡的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握化学反应速率、物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:实验题
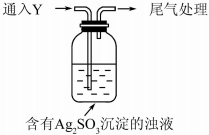 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D是非金属性最强的元素 | |
| B. | B的单质有多种同分异构体,其中一种是自然界中最坚硬的物质 | |
| C. | B的氢化物的稳定性大于D的氢化物 | |
| D. | A与C只能够形成两种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
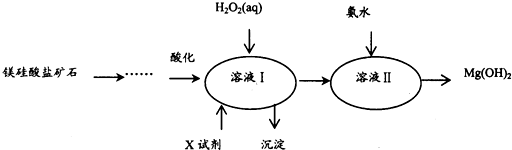
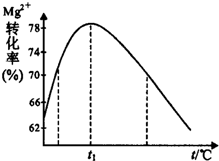
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷 | B. | 丙烷 | ||
| C. | 2-甲基丙烷(CH3)3CH | D. | 2,2-二甲基丙烷(CH3)4C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溴乙烷中的溴:取溴乙烷加氢氧化钠溶液,加热,再加硝酸银溶液有浅黄色沉淀生成 | |
| B. | 检验葡萄糖:在硝酸银溶液中滴加稀氨水至沉淀恰好溶解再加少许葡萄糖溶液,水浴加热 | |
| C. | 检验乙醛:加入2% 硫酸铜溶液2 mL再加入2% NaOH溶液2 mL;加热至沸腾 | |
| D. | 实验室制乙烯:取浓硫酸和乙醇体积比1:3的溶液加热到170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
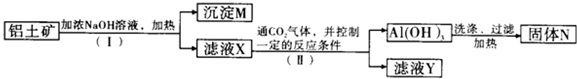
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
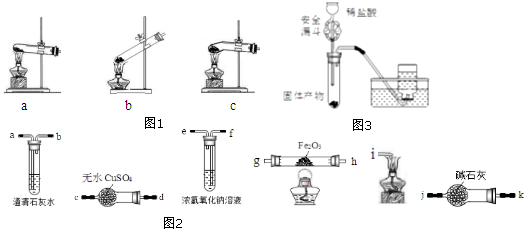
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
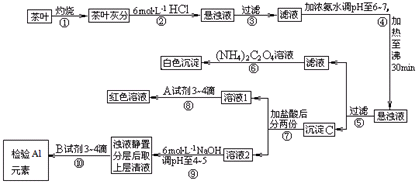
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com