
| A、用等体积的蒸馏水或0.01mol/L盐酸洗涤AgCl沉淀,AgCl的损失量相同 |
| B、向氨水中加入NH4Cl 或Na2CO3 固体,溶液的pH均增大,水的电离程度均增大 |
| C、稀醋酸加入少量NaOH,恢复至室温后溶液的H+浓度减少,醋酸电离平衡常数不变 |
| D、NaClO与Na2CO3等物质的量混合的溶液中:c(Na+ )+c(H+)=c(OH-)+c(ClO-)+c(HCO3 -)+2c(CO32-) |


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、上述实验中,共有两个氧化还原反应 |
| B、上述实验证明还原性:Fe2+>Br->Cl->Mn2+ |
| C、实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| D、实验③证明Fe2+既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
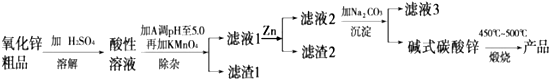
查看答案和解析>>
科目:高中化学 来源: 题型:
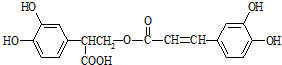 ,以邻苯二酚为原料合成迷迭香酸的路线为:
,以邻苯二酚为原料合成迷迭香酸的路线为:
| A、有机物A分子中所有原子一定在同一平面上 |
| B、有机物C在浓硫酸催化下水解的一种产物是B |
| C、有机物B可以发生取代、加成、消去、氧化反应 |
| D、1 mol迷迭香酸分别与足量的NaOH溶液、浓溴水反应,最多可消耗NaOH、Br2均为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、Na+、SO42-、Cl- |
| B、K+、Na+、HCO3-、NO3- |
| C、OH-、HCO3-、Ca2+、Na+ |
| D、Ba2+、Na+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com