
在0.1mol/L的醋酸溶液中存在下列平衡:CH3COOH 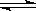 H++CH3COO-,要使该平衡右移且使氢离子浓度增大,应采取的措施是
H++CH3COO-,要使该平衡右移且使氢离子浓度增大,应采取的措施是
A.加入NaOH B.加入盐酸 C.加水 D.升高温度
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
已知某溶液中存在OH-、H+、NH4+、Cl- 四种离子。某同学推测其离子浓度大小顺序有如下关系:
①.c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③.c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是_____________________(填化学式)上述四种离子浓度的大小关系为_____________(填序号)
(2)若上述关系中③是正确的,则溶液中的溶质为_____________________(填化学式)
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)______________c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
X和Y两种元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,Z和X两种元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径,X、Y、Z三种元素原子序数的关系是
A.X>Y>Z B.Y>X>Z C.Z>X>Y D.Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B.CaCO3难溶于稀硫酸,也难溶于醋酸
C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
D.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH________11(填“>”“=”或“<”)原因是______________________________________________(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH________NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH )由大到小的顺序为________;
)由大到小的顺序为________;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH )=c(Cl-),则混合后溶液呈________性,盐酸的体积________氨水的体积(填“>”“=”或“<”);
)=c(Cl-),则混合后溶液呈________性,盐酸的体积________氨水的体积(填“>”“=”或“<”);
(5)NaHSO4在水中的电离方程式为NaHSO4===Na++H++SO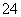 。该溶液中c(H+)_________________________c(OH-)+c(SO
。该溶液中c(H+)_________________________c(OH-)+c(SO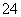 )(填“>”“=”或“<”)。
)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水。当K闭合后,在交换膜处SO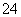 从右向左移动。下列分析不正确的是
从右向左移动。下列分析不正确的是
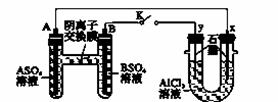
A.溶液中[A2+]增大 B.B的电极反应:B―→B2++2e-
C.y电极上有Cl2产生,发生氧化反应
D.反应初期x电极周围出现白色沉淀,随后沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:___________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时
c(CH3OH) = ;该时间内反应速率v(CH3OH) = 。
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成下列问题:
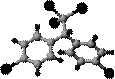
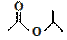 ⑴某有机物的键线式是 请写出它与NaOH溶液反应的化学方程式 ▲ :
⑴某有机物的键线式是 请写出它与NaOH溶液反应的化学方程式 ▲ :
⑵DDT人类合成的第一种有机氯农药,其分子结构球棍模型如
右图所示。请分析该物质的核磁共振1H谱图中有 ▲ 个
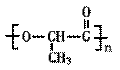 吸收峰。
吸收峰。
 ⑶)F和G( ) 是日常生活中常用的两种合成高分子材料,可由某烃 经下列反应得到。
⑶)F和G( ) 是日常生活中常用的两种合成高分子材料,可由某烃 经下列反应得到。
请回答下列问题:
①F的结构简式为 ▲ 。
②C中所含官能团的名称为 ▲ ,用 ▲ 仪,可以测定D中所含官能团。
③A→B的化学方程式为 ▲ 。
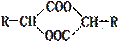
 ④已知 2RCH(OH)COOH 2H2O +
④已知 2RCH(OH)COOH 2H2O +
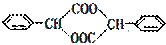 请参考题目中的合成途径,若合成 ,起始原料的某烃的结构简式为 ▲ ,最少用 ▲ 步反应,可以合成产物。
请参考题目中的合成途径,若合成 ,起始原料的某烃的结构简式为 ▲ ,最少用 ▲ 步反应,可以合成产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:CO(g)  C(s) +
C(s) + 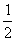 O2(g)的△H为正值,△S为负值。设△H和△S不随温度而变化,下列说法中正确的是( )
O2(g)的△H为正值,△S为负值。设△H和△S不随温度而变化,下列说法中正确的是( )
A.低温下是自发变化
B.高温下是自发变化
C.低温下是非自发变化,高温下是自发变化
D.任何温度下都是非自发变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com