
【题目】碳及其化合物在能源、材料等方面具有广泛的用途。回答下列问题:
(1)碳酸和草酸(H2C2O4)均为二元弱酸,其电离均为分步电离,二者的电离常数如下表:
H2CO3 | H2C2O4 | |
K1 | 4.2×107 | 5.4×102 |
K2 | 5.6×1011 | 5.4×105 |
①向碳酸钠溶液中滴加少量草酸溶液所发生反应的离子方程式为_____________。
②浓度均为0.1 mol·L1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液,其溶液中H+浓度分别记作c1、c2、c3、c4。则四种溶液中H+浓度由大到小的顺序为________________。
(2)常温时,C和CO的标准燃烧热分别为394.0 kJ·mol1、283.0 kJ·mol1,该条件下C转化为CO的热化学方程式为____________________。
(3)氢气和一氧化碳在一定条件下可合成甲醇,反应如下:2H2(g)+CO(g)![]() CH3OH(g) ΔH=Q kJ·mol1
CH3OH(g) ΔH=Q kJ·mol1
①该反应在不同温度下的化学平衡常数(K)如下表:
温度/℃ | 250 | 300 | 350 |
K/L2·mol2 | 2.041 | 0.270 | 0.012 |
由此可判断Q______(选填“ >”或“<”)0。
②一定温度下,将6 mol H2和2 mol CO充入体积为2 L的密闭容器中,10 min反应达到平衡状态,此时测得c(CO)=0.2 mol·L1,该温度下的平衡常数K=____,0~10 min内反应速率v(CH3OH)=______。
③在两个密闭容器中分别都充入20 mol H2和10 mol CO,测得一氧化碳的平衡转化率随温度(T)、压强(p)的变化如图所示:

若A点对应容器的容积为20 L,则B点对应容器的容积为____L。
【答案】 H2C2O4+ 2![]()
![]() 2
2![]() +
+![]() c4>c3>c2>c1 2C(s)+O2(g)
c4>c3>c2>c1 2C(s)+O2(g) ![]() 2CO(g) ΔH=222.0 kJ·mol1 < 2.041 L2·mol2 0.08 mol·L1·min1 4
2CO(g) ΔH=222.0 kJ·mol1 < 2.041 L2·mol2 0.08 mol·L1·min1 4
【解析】(1)由图表可知草酸的一级电离、二级电离均大于碳酸的一级、二级电离,即HC2O4-的酸性比H2CO3强,则向碳酸钠溶液中滴加少量草酸溶液所发生反应的离子方程式为H2C2O4+ 2![]()
![]() 2
2![]() +
+![]() ;②由碳酸和草酸的两步电离常数可知酸性强弱顺序为H2C2O4>
;②由碳酸和草酸的两步电离常数可知酸性强弱顺序为H2C2O4>![]() >H2CO3>
>H2CO3>![]() ,酸性越弱,其对应的强碱盐水解程度越大,盐溶液的碱性越强,c(H+)越小,故浓度均为0.1 mol·L-1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液中c(H+)逐渐增大,即c4>c3>c2>c1;(2)由已知C和CO的标准燃烧热数据可写出其热化学方程式:①C(s)+O2(g)
,酸性越弱,其对应的强碱盐水解程度越大,盐溶液的碱性越强,c(H+)越小,故浓度均为0.1 mol·L-1的Na2CO3溶液、NaHCO3溶液、Na2C2O4溶液、NaHC2O4溶液中c(H+)逐渐增大,即c4>c3>c2>c1;(2)由已知C和CO的标准燃烧热数据可写出其热化学方程式:①C(s)+O2(g)![]() CO2(g) ΔH=-394.0 kJ·mol-1、②CO(g)+
CO2(g) ΔH=-394.0 kJ·mol-1、②CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH=-283.0 kJ·mol-1,根据盖斯定律,由(①-②)×2可得:2C(s)+O2(g)
CO2(g) ΔH=-283.0 kJ·mol-1,根据盖斯定律,由(①-②)×2可得:2C(s)+O2(g)![]() 2CO(g) ΔH=(-394.0 kJ·mol-1+283.0 kJ·mol-1)×2=-222.0 kJ·mol-1;(3)①由表格中的平衡常数数据可知,温度越高,平衡常数越小,即升高温度,平衡逆向移动,故正反应为放热反应,即Q<0。②由题意可知,平衡时c(H2)=1.4 mol·L-1,c(CO)=0.2 mol·L-1,c(CH3OH)=0.8 mol·L-1,则K=
2CO(g) ΔH=(-394.0 kJ·mol-1+283.0 kJ·mol-1)×2=-222.0 kJ·mol-1;(3)①由表格中的平衡常数数据可知,温度越高,平衡常数越小,即升高温度,平衡逆向移动,故正反应为放热反应,即Q<0。②由题意可知,平衡时c(H2)=1.4 mol·L-1,c(CO)=0.2 mol·L-1,c(CH3OH)=0.8 mol·L-1,则K=![]() ≈2.041 L2·mol-2,v(CH3OH)=0.8 mol·L-1÷10 min=0.08 mol·L-1·min-1span>。③由图示可知B处的转化率高于A处,而已知反应为增大压强平衡正向移动的反应,因此压强p1<p2。达平衡状态A时,CO的转化率为0.5,此时CO为5 mol,H2为10 mol,CH3OH为5 mol;达平衡状态B时,CO的转化率为0.8,此时CO为2 mol,H2为4 mol,CH3OH为8 mol。由于温度相同,化学平衡常数相同。设V(B)为VL,则
≈2.041 L2·mol-2,v(CH3OH)=0.8 mol·L-1÷10 min=0.08 mol·L-1·min-1span>。③由图示可知B处的转化率高于A处,而已知反应为增大压强平衡正向移动的反应,因此压强p1<p2。达平衡状态A时,CO的转化率为0.5,此时CO为5 mol,H2为10 mol,CH3OH为5 mol;达平衡状态B时,CO的转化率为0.8,此时CO为2 mol,H2为4 mol,CH3OH为8 mol。由于温度相同,化学平衡常数相同。设V(B)为VL,则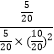 =
=![]() ,解得V=4。
,解得V=4。


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】图甲中①②③④表示不同化学元素所组成的化合物,图乙表示由四个单体构成的化合物。以下说法不正确的是( )

A. 若图甲中的②大量存在于皮下和内脏器官周围等部位,则②是脂肪
B. 若图甲中④能吸收、传递和转换光能,则④可用无水乙醇提取
C. 图乙中若单体是氨基酸,则该化合物彻底水解后的产物中氧原子数增加3个
D. 图乙中若单体是四种脱氧核苷酸,则该化合物彻底水解后的产物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是:
①需要加热才能发生的反应一定是吸热反应;②放热反应在常温下一定很容易发生;③一个化学反应是放热反应还是吸热反应,必须看反应物和生成物所具有的总能量的相对大小;④有的吸热反应在常温下也能发生。
A.①②③④B.①②C.②③④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 由水电离出的c(H+)=10-12mol·L-1的溶液中:Mg2+、K+、Br-、HCO3-
B. 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
C. 含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
D. 使酚酞变红色的溶液:Na+、Ba2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度压强下,用mg的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )
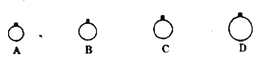
A.气球B中装的是O2
B.气球A和气球C中气体分子数相等
C.气球A和气球D中气体物质的量之比为4:1
D.气球C和气球D中气体密度之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用SO2与Cl2在活性炭的催化下制取一种重要的有机合成试剂磺酰氯(SO2Cl2)。所用的反应装置如下图所示(部分夹持装置省略)。
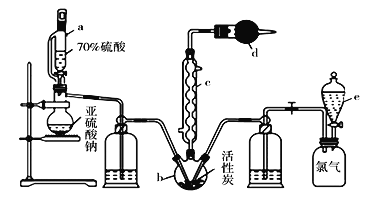
已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,遇潮湿空气会产生白雾。现拟用干燥的Cl2和SO2在活性炭催化下制取磺酰氯:Cl2(g)+SO2(g)![]() SO2Cl2(l),实验装置如图所示。
SO2Cl2(l),实验装置如图所示。
(1)化合物SO2Cl2中S元素的化合价为__________。
(2)仪器c的名称是_________,c中通入冷水的作用是___________
(3)由仪器c的使用可知SO2与Cl2的反应ΔH____0(填“<”或“>”),仪器d 的作用是____。
(4)采用上述部分装置获得干燥的原料气Cl2与SO2。装置e中所盛放的溶液为______(填溶液的名称)。
(5)SO2Cl2遇水能发生剧烈的水解反应,会产生白雾,则SO2Cl2发生水解反应的化学方程式为_______。
(6)反应结束后,将仪器b里的混合物分离的方法是______,
若反应中消耗氯气的体积为1.12L(已转化为标准状况,SO2足量),最后通过蒸馏得到纯净的磺酰氯5.13g,则磺酰氯的产率为___(保留三位有效数字)。
(7)为提高本实验中磺酰氯的产率,在实验操作中需要注意的事项有_____(填序号)。
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈瓶发烫,可适当降温 ④加热三颈瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳排放是影响气候变化的重要因素之一。最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。下列有关说法中不正确的是( )
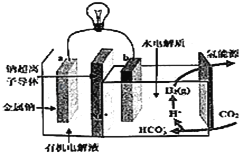
A. 系统工作时,化学能转变成电能
B. 系统工作时,电流由a极沿导线流向b极
C. 系统工作时,b极区可能会析出固体
D. 系统工作时,b极区的电极反应式为2CO2+2H2O+2e﹣=2HCO3﹣+H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com