
�������п�ͼ��ϵ��գ���֪��Ӧ�١������ҹ���ҵ�����е���Ҫ��Ӧ��X������Ϊ��ɫ��ζ��Һ�壻C��ɫ��Ӧ����ʻ�ɫ��JΪ���ɫ������D��E������Ϊ���壬��E��ʹƷ����Һ��ɫ��A�����н�������Ԫ�أ����н���Ԫ�ص���������ԼΪ46.7%��
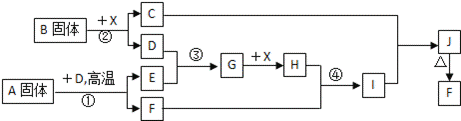
��1��A�Ļ�ѧʽΪ������ F�Ļ�ѧʽΪ������
��2����Ӧ �۵Ļ�ѧ����ʽ��������
��3����Ӧ�ڵ����ӷ���ʽ��������
��4����Ӧ�ܵ����ӷ���ʽ��������
��5����֪ÿ����16g E���ų�106.5kJ��������Ӧ�ٵ��Ȼ�ѧ����ʽΪ��������
| ������ƶϣ�. | |
| ר�⣺ | �ƶ��⣮ |
| ������ | X������Ϊ��ɫ��ζ��Һ���ƶ�Ϊˮ��C��ɫ��Ӧ����ʻ�ɫ˵������Ԫ�أ�JΪ���ɫ����Ϊ����������FΪFe2O3��D��E������Ϊ���壬��E��ʹƷ����Һ��ɫ˵��EΪSO2��GΪSO3��HΪH2SO4��IΪ��������˼· 1��3������Ӧ����D����1�Ǹ��������·�Ӧ�ģ���������DΪ������������Ӧ��������BΪ�������ƣ�CΪ�������ƣ�DΪ������A��D�ڸ����·�Ӧ���ɶ�������ͺ��������Ļ������ҵ�ϳ��õ������������е���Ҫ��Ӧ������Ĺ�ҵ����������Ĺ�ҵ����������Ĺ�ҵ����ԭ�϶�Ϊ������ͻ��������������ǻ���������AΪFeS2�������жϳ������ʽ��з����жϣ�AΪ����������������BΪ�������ƣ�CΪNaOH��xΪˮ��DΪ������EΪSO2��FΪ��������GΪSO3��HΪ���ᣬIΪ��������JΪ���������� |
| ��� | �⣺�������п�ͼ��ϵ��գ���֪��Ӧ�١������ҹ���ҵ�����е���Ҫ��Ӧ��X������Ϊ��ɫ��ζ��Һ���ƶ�Ϊˮ��C��ɫ��Ӧ����ʻ�ɫ˵������Ԫ�أ�JΪ���ɫ����Ϊ����������FΪFe2O3��D��E������Ϊ���壬��E��ʹƷ����Һ��ɫ˵��EΪSO2��GΪSO3��HΪH2SO4��IΪ��������˼· 1��3������Ӧ����D����1�Ǹ��������·�Ӧ�ģ���������DΪ������������Ӧ��������BΪ�������ƣ�CΪ�������ƣ�DΪ������A��D�ڸ����·�Ӧ���ɶ�������ͺ��������Ļ������ҵ�ϳ��õ������������е���Ҫ��Ӧ������Ĺ�ҵ����������Ĺ�ҵ����������Ĺ�ҵ����ԭ�϶�Ϊ������ͻ��������������ǻ���������AΪFeS2�� ��AΪFeS2����BΪNa2O2��CΪNaOH��xΪH2O����DΪ������EΪSO2��FΪFe2O3��GΪSO3��HΪ���ᣬIΪ��������JΪ���������� ��1�����ݷ����жϽ����AΪ��FeS2��FΪ Fe2O3�� �ʴ�Ϊ��FeS2��Fe2O3�� ��2����Ӧ���Ƕ�������������ķ�Ӧ����Ӧ����ʽΪ2SO2+O2 �ʴ�Ϊ��2SO2+O2 ��3����Ӧ���ǹ���������ˮ��Ӧ����Ӧ�����ӷ���ʽΪ��2Na2O2+2H2O=4Na++4OH��+O2���� �ʴ�Ϊ��2Na2O2+2H2O=4Na++4OH��+O2���� ��4����Ӧ�������������������ᷴӦ����Ӧ�����ӷ���ʽΪ��Fe2O3+6H+=2Fe3++3H2O�� �ʴ�Ϊ��Fe2O3+6H+=2Fe3++3H2O�� ��5����֪ÿ����16g EΪSO2�����ʵ���Ϊ0.25mol���ų�106.5kJ���������ݻ�ѧ����ʽ4FeS2��s��+11O2��g��=2Fe2O3��s��+8SO2��g��������8molSO2������Ϊ�� �ʴ�Ϊ��FeS2��s��+ |
| ������ | ���⿼��������ת����ϵ���������ʵ�Ӧ�ã�������Ӧ������Ӧ�ã���ҵ����������Ӧ�ã���Ҫ�������仯���������Ӧ�á�����ʽ����д�����ӷ���ʽ��д���Ȼ�ѧ����ʽ��д�����������������ʺ�����ת���ǹؼ��� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ѪҺ�ɿ���һ�ֽ��塣ijЩ��������������Ҫ������ѪҺ�����Գ�ȥ��ѪҺ�л��۹�������ӣ�ͬʱ��ѪҺ�в���������Ҫ�Ļ�ѧ�ɷ֡�ѪҺ�������У���Ϊ�ؼ�����������Ĥ������Ϊ��Ĥ�Ŀ���ԼӦ��Ϊ(����)
A��0.1 nm���� B��50 nm����
C��0.001 mm���� D��100 mm����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����̼��ƹ㷺Ӧ���������ϡ���ֽ����ѧ���ġ���ī��Ϳ�ϡ��ܷ⽺�뽺ճ������ҵ����ŨCaCl2��Һ��ͨ��NH3��CO2�������Ƶ�����̼��ơ�ijУѧ��ʵ��С�������ͼ��ʾװ�ã���ȡ�ò�Ʒ��D��װ��պϡ�������֬�ޣ�ͼ�мг�װ������ȥ��
��ѡ�õ�ҩƷ�У�
a��ʯ��ʯ��b�������Ȼ�����Һ��c��6 mol/L���d���Ȼ�泥�e����������
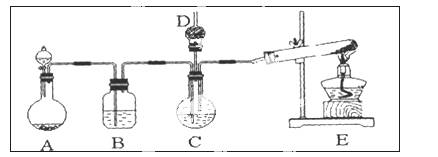
��1��A���Ʊ�����ʱ������ҩƷ�ǣ�ѡ����ĸ��ţ� ��
��2��B��ʢ�б���̼��������Һ���������� ��
��3��д����ȡ�����Ļ�ѧ����ʽ ��
��4����ʵ������У���C��ͨ�����������Ⱥ�˳��ģ�Ӧ��ͨ������Ļ�ѧʽ ��
��5������D���ڴ��Ƿ��а����ݳ��ķ����� ��
��6��д��������̼��ƵĻ�ѧ����ʽ ��
��7����ʵ��������а����ݳ���Ӧѡ������ װ�û��գ�����ţ���
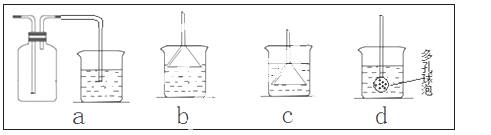
�������������Ȼ����Ʒ�к�������̼�����ơ�Ϊ�˲ⶨ�Ȼ�淋�������������ѧ��ʵ��С�������������ʵ�����̣�
�Իش�
��1�������Լ�A�Ļ�ѧʽΪ
��2��B����������
��3����Ʒ���Ȼ�淋���������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���淴Ӧ��2NO2⇌2NO+O2�ڹ̶�����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�ǣ�������
�ٵ�λʱ��������n mol O2��ͬʱ����2n mol NO2��
�ڵ�λʱ��������n mol O2 ��ͬʱ������2n mol NO��
����NO2��NO��O2 �����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1��״̬��
�ܻ���������ɫ���ٸı��״̬��
�ݻ��������ܶȲ��ٸı��״̬��
��������ƽ����Է����������ٸı��״̬��
| �� | A�� | �٢ܢ� | B�� | �ڢۢ� | C�� | �٢ۢ� | D�� | �٢ڢۢܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
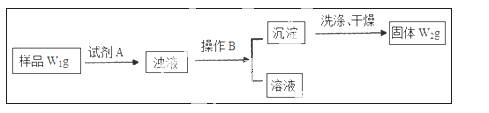
��������Ϊa��ij���ʵ���Һm g����������Ϊb�ĸ����ʵ���Һn g��Ϻ�������p gˮ���õ�����Һÿ��������Ϊq g�����ʵ���Ũ��Ϊc�������ʵķ���������Է���������Ϊ��������
| �� | A�� |
| B�� |
|
| �� | C�� |
| D�� |
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з���������ԭ�Ӷ����������Ϊ8�����ӽṹ����
A��BF3 B��PCl5 C��H2O D��CCl4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���б仯�Т�NaCl����ˮ ��HCl����ˮ ��O2 ����ˮ ��Na2O2����ˮ ��ˮ���������� ����NaOH�ۻ� ��δ������ѧ���ƻ����� �� ���������ۼ��ƻ����� ���ȷ������Ӽ��ƻ����ַ������ۼ��ƻ����� ������ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������һ�ȴ�����ͬ���칹����ǣ� ��
A�������顡 B������ C��2�������� D��2��2����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com