
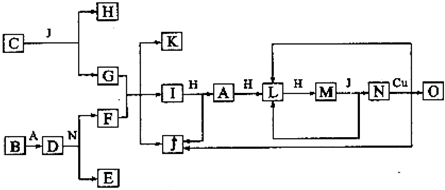
已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。
A. B.H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。

请回答下列问题:
(1)组成B单质的元素位于周期表第___周期,第____族。化合物C的电子式为______。
(2)通常情况下J为液体,用电子式表示其形成过程为_________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:________________。
(4)写出D与足量的N反应生成E和F的化学方程式:_____________________。
科目:高中化学 来源: 题型:
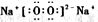
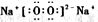
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A—O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。请回答下列问题:
⑴组成B单质的元素位于周期表位置________________。化合物C电子式为____________。
⑵J的沸点比硒化氢(H2Se)的熔沸点高,其原因是_________________。
⑶I与H在一定条件下也可直接反应生成L和J, 写出化学方程式:_______________。
⑷写出D与水反应的化学方程式:_____________________。
⑸红棕色污染气体M的处理具有实际意义。现在常利用反应
M + NH3N2+H2O(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。
A. B.H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
请回答下列问题:
(1)组成B单质的元素位于周期表第___周期,第____族。化合物C的电子式为______。
(2)通常情况下J为液体,用电子式表示其形成过程为_________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:________________。
(4)写出D与足量的N反应生成E和F的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高一下学期期中考试化学试卷(解析版) 题型:填空题
已知A—O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。请回答下列问题:
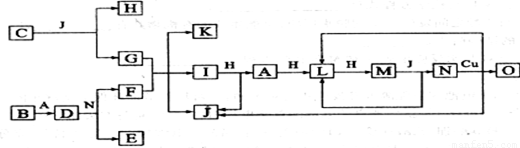
⑴组成B单质的元素位于周期表位置________________。化合物C电子式为____________。
⑵J的沸点比硒化氢(H2Se)的熔沸点高,其原因是_________________。
⑶I与H在一定条件下也可直接反应生成L和J, 写出化学方程式:_______________。
⑷写出D与水反应的化学方程式:_____________________。
⑸红棕色污染气体M的处理具有实际意义。现在常利用反应
M + NH3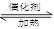 N2+H2O(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是
L。
N2+H2O(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是
L。
查看答案和解析>>
科目:高中化学 来源:2010年安丘中学高二暑期练习化学卷(一) 题型:填空题
已知A—O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。请回答下列问题:
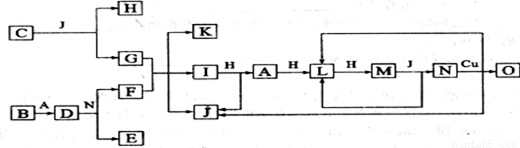
⑴组成B单质的元素位于周期表位置________________。化合物C电子式为____________。
⑵J的沸点比硒化氢(H2Se)的熔沸点高,其原因是_________________。
⑶I与H在一定条件下也可直接反应生成L和J, 写出化学方程式:_______________。
⑷写出D与水反应的化学方程式:_____________________。
⑸红棕色污染气体M的处理具有实际意义。现在常利用反应
M + NH3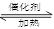 N2+H2O(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是
L。
N2+H2O(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是
L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com