
| A. | HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l) | B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) | ||
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) | D. | 2H2(g)+O2(g)═2H2O(l) |
分析 常温能自动发生的氧化还原反应可设计成原电池,有元素化合价变化的反应为氧化还原反应,以此来解答.
解答 解:A.HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)中没有元素的化合价变化,不是氧化还原反应,则不能用于设计原电池,故A选;
B.CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O中,C、O元素的化合价变化,属于氧化还原反应,能用于设计原电池,故B不选;
C.4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)中有元素的化合价变化,是氧化还原反应,则能用于设计原电池,故C不选;
D.H2(g)+O2(g)═2H2O(l)中,H、O元素的化合价变化,属于氧化还原反应,能用于设计原电池,故D不选;
故选A.
点评 本题考查原电池的设计,明确能自动发生的氧化还原反应能设计成原电池是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
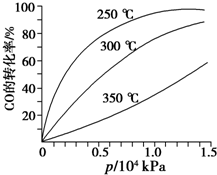 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| B. | 加水,反应速率增大,平衡向逆反应方向移动 | |
| C. | 滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 银制奖牌久置后表面变暗镀锌的铁比镀锡的铁耐用 | |
| C. | 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 | |
| D. | 镀锌的铁比镀锡的铁耐用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中C、H、O个数之比为1:2:3 | B. | 分子中C、H个数之比为1:2 | ||
| C. | 有机物一定是CH4 | D. | 有机物可能是CH4O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后所得溶液的溶质是强酸弱碱盐 | |
| B. | 弱酸溶液和强碱溶液反应 | |
| C. | 强酸溶液和弱碱溶液反应 | |
| D. | 一元强酸溶液和一元强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用镊子夹取钠块,吸干表面的煤油后,用小刀切下一部分进行实验.剩余的钠应放回原试剂瓶 | |
| B. | 钠加热后先熔化成小球状,这是因为金属钠的熔点较低 | |
| C. | 钠燃烧时火焰呈黄色,这与钠元素的焰色反应有关 | |
| D. | 钠块表面若有部分已被氧化为Na2O,充分燃烧后将得到Na2O和Na2O2的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com