
| A、Na+、OH-、HCO3- |
| B、Ba2+、OH-、Cl- |
| C、H+、K+、CO32- |
| D、NH4+、NO3-、OH- |


科目:高中化学 来源: 题型:

| 步骤 | 实验操作 | 实验现象、结论 |
| 1 | 取一定量3mol/L硫酸溶液于试管中,加热煮沸去除溶解氯气 | / |
| 2 | 取少量产品于试管中,加适量步骤1处理好的溶液,溶解、配成溶液 | 固体溶解,溶液呈浅黄色 |
| 3 | 取少量步骤2配好的溶液于试管中,滴加几滴20%硫氰化钾溶液,振荡 | |
| 4 | |
| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
48 22 |
| A、质子数为48 |
| B、原子序数为22 |
| C、质量数为22 |
| D、中子数为48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2只是氧化剂 |
| B、H2O是还原剂 |
| C、Cl2既是氧化剂又是还原剂 |
| D、H2O既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CrO3是氧化剂 |
| B、该反应为复分解反应 |
| C、反应中转移的电予数为6e- |
| D、C2H5OH中碳元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
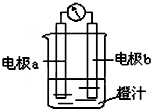 利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )
利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )| A、a为镁条、b为锌片时,镁条为负极 |
| B、a为镁条、b为锌片时,导线中会产生电流 |
| C、铜极上发生还原反应 |
| D、a为锌片、b为铜片时,电子由铜片通过导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com