
 A��B��D��X��Y���ɶ�����Ԫ����ɵĻ��������X�dz�����ǿ�ᣨ�����ᣩ��Y�dz�����ǿ����������ƣ������ǵ��ת����ϵ����ͼ�������������ˮ��ȥ����
A��B��D��X��Y���ɶ�����Ԫ����ɵĻ��������X�dz�����ǿ�ᣨ�����ᣩ��Y�dz�����ǿ����������ƣ������ǵ��ת����ϵ����ͼ�������������ˮ��ȥ����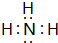 ��������������������NO��ˮ����Ӧ����ʽΪ��4NH3+5O2
��������������������NO��ˮ����Ӧ����ʽΪ��4NH3+5O2
| ||
| �� |
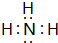 ��4NH3+5O2
��4NH3+5O2
| ||
| �� |
| 11.2L |
| 22.4L/mol |


 �ظ���ʦ�㲦ϵ�д�
�ظ���ʦ�㲦ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��K+��Na+��SO42- |
| B��K+��H+��OH- |
| C��Na+��Ag+��Cl- |
| D��Ca2+��OH-��CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
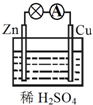 ������ͼ��ʾ��ԭ��أ�����˵������ȷ���ǣ�������
������ͼ��ʾ��ԭ��أ�����˵������ȷ���ǣ�������| A��CuΪ������ZnΪ���� |
| B����װ���ܽ���ѧ��ת��Ϊ���� |
| C��������ͭƬͨ����������пƬ |
| D��������ӦΪ 2H++2e-�TH2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
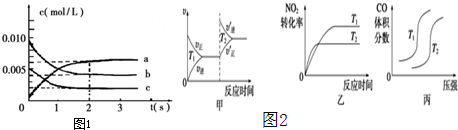 ���Ǵ����к����������壬�о������仯�������������Ҫ�����壮
���Ǵ����к����������壬�о������仯�������������Ҫ�����壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��һ�������½��л�ѧ��Ӧ����������µ�ת����ϵ�ش��������⣬
��һ�������½��л�ѧ��Ӧ����������µ�ת����ϵ�ش��������⣬�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | X | Y | Z |
| ��ʼŨ��/mol?L-1 | 0.1 | 0.15 | 0 |
| ƽ��Ũ��/mol?L-1 | 0.01 | 0.105 | 0.09 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com