
【题目】下表是元素周期表的一部分,根据表中给出的①—⑥六种元素,回答下列问题:
族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ |
(1)画出元素④的原子结构示意图__________;
(2)元素①形成的最简单有机物的化学式是__________;
(3)表中所列元素中非金属性最强的元素是__________(填元素符号)
(4)元素⑤形成的最高价氧化物对应的水化物的化学式是__________;
(5)元素③和元素⑥形成的化合物的电子式是__________。
(6)表中所列元素中金属性最强的元素是__________(填元素符号)
【答案】 ![]() CH4 F H2SO4
CH4 F H2SO4 ![]() Na
Na
【解析】首先依据元素在周期表中的位置判断出元素名称,然后结合元素周期律分析解答。
根据元素在周期表中的相对位置可知①~⑥分别是C、F、Na、Mg、S、Cl。则
(1)元素④是镁,其原子结构示意图为![]() ;
;
(2)元素①是碳,形成的最简单有机物是甲烷,其化学式是CH4;
(3)同主族从上到下非金属性逐渐减弱,同周期自左向右非金属性逐渐增强,则表中所列元素中非金属性最强的元素是F;
(4)元素⑤是硫,形成的最高价氧化物对应的水化物是硫酸,其化学式是H2SO4;
(5)元素③和元素⑥形成的化合物是氯化钠,含有离子键,电子式是![]() 。
。
(6)同主族从上到下金属性逐渐增强,同周期自左向右金属性逐渐减弱,则表中所列元素中金属性最强的元素是Na。


科目:高中化学 来源: 题型:
【题目】将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一固定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 ![]() 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2 , 气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题(计算结果保留一位小数):
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量的NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2 , 气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。请回答下列问题(计算结果保留一位小数):
(1)判断该反应达到平衡状态的标志是。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.向装置中再充入SO3
(3)求该反应达到平衡时SO2的转化率为(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的Ba(OH)2溶液,生成沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.烧碱、液态氧、碘酒B.生石灰、白磷、熟石灰
C.干冰、水银、氯化氢D.空气、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为VL的恒容密闭容器中盛有一定量H2 , 通入Br2(g)发生反应:H2(g)+Br2(g) ![]() 2HBr(g) △H<0。当温度分别为T1、T2平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是( )
2HBr(g) △H<0。当温度分别为T1、T2平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是( )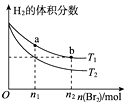
A.由图可知:T2>T1
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是
A.氧化还原反应的本质是元素化合价发生变化
B.物质所含元素化合价降低的反应是氧化反应
C.置换反应一定属于氧化还原反应
D.化合反应和分解反应不可能是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
(1)Ⅰ.将NaOH溶液与NH4Cl溶液混合生成NH3·H2O ,从而验证NaOH的碱性大于NH3·H2O继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由: 。
(2)Ⅱ.利用下图装置可以验证非金属性的变化规律。干燥管D的作用是。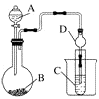
实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2 , 请选择合适药品设计实验验证氯的非金属性大于硫:烧瓶中发生反应的离子方程式为。
装置C中的实验现象为有淡黄色沉淀生成,离子方程式为。
(3)若要用此装置证明酸性:H2CO3>H2SiO3进而证明非金属性:C>Si,则A中加观察到C中溶液的现象为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com