
| A、原子半径:Z>X>Y |
| B、X元素形成的单质其摩尔质量一定是32g?moL-1 |
| C、物质A中既含离子键又含共价键 |
| D、YX2、ZX2都有对应的含氧酸 |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在铁片上镀铜时,若阴极增重3.2g,则电镀液中通过的电子的物质的量为0.1mol |
| B、钢铁电化学腐蚀的两种类型主要区别在于水膜的PH不同,引起的负极反应不同 |
| C、参加反应的物质的性质是决定化学反应速率的重要因素 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极区产生的Cl2进入阳极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径的大小顺序为:X>Y>Z>Q |
| B、离子半径的大小顺序为:Xm+>Yn+>Zm->Qn- |
| C、m+a=d-n |
| D、b-n=c+m |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑤ | B、②③④⑥ |
| C、①②⑥ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在非标准状况下,1 mol O2的体积也有可能是22.4 L |
| B、在温度和压强一定时,气态物质的体积主要由气体分子数目和分子的大小决定 |
| C、同温同压下,0.3 mol N2和0.7 mol O2的体积比为3:7 |
| D、同温同压下,相同体积的任何气体所含有的分子数目一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
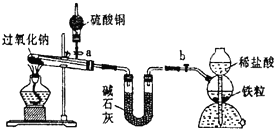 Na2O2是中学化学常用的强氧化剂,除了能与C02、H20反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.
Na2O2是中学化学常用的强氧化剂,除了能与C02、H20反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com