
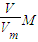 =
= ;电解水时,生成氢气与氢氧化钠的物质的量之比为1:2,所以生成氢氧化钠的质量=2
;电解水时,生成氢气与氢氧化钠的物质的量之比为1:2,所以生成氢氧化钠的质量=2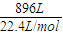 ×40g/mol=3200g,溶液增加的质量为增加的钠元素的质量减去生成氢气的质量=2×
×40g/mol=3200g,溶液增加的质量为增加的钠元素的质量减去生成氢气的质量=2× -80g=1760g;溶液中溶质氢氧化钠的质量为10000g×10%+3200g=4200g,溶液的质量为10000g+1760g=11760g,
-80g=1760g;溶液中溶质氢氧化钠的质量为10000g×10%+3200g=4200g,溶液的质量为10000g+1760g=11760g, =35.7%,
=35.7%,

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
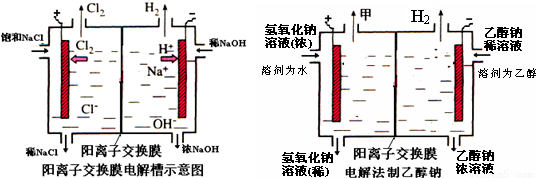
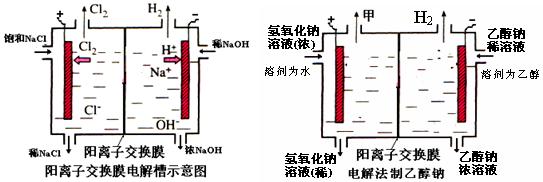
(10分)工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
⑴这种阳离子交换膜,只允许溶液中的 ▲ 通过。(填下列微粒的编号)
⑵写出在电解过程中阳极发生的电极方程式: ▲ 。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为
▲ 。
⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
①写出在电解过程中阴极发生的电极方程式 ▲ 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: ▲ 。
查看答案和解析>>
科目:高中化学 来源:09—10年扬州中学高一下学期期末考试化学卷 题型:填空题
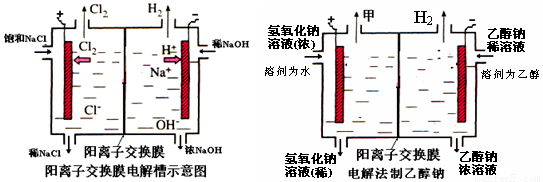
(10分)工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
⑴这种阳离子交换膜,只允许溶液中的 ▲ 通过。(填下列微粒的编号)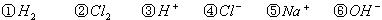
⑵写出在电解过程中阳极发生的电极方程式: ▲ 。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为
▲ 。
⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
①写出在电解过程中阴极发生的电极方程式 ▲ 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: ▲ 。
查看答案和解析>>
科目:高中化学 来源:09-10年扬州中学高一下学期期末考试化学卷 题型:填空题
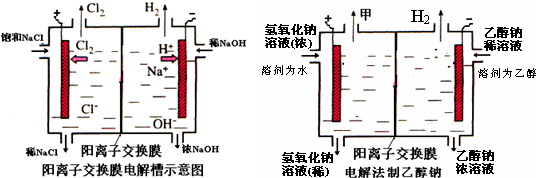
(10分)工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
⑴这种阳离子交换膜,只允许溶液中的 ▲ 通过。(填下列微粒的编号)

⑵写出在电解过程中阳极发生的电极方程式: ▲ 。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为
▲ 。
⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
①写出在电解过程中阴极发生的电极方程式 ▲ 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: ▲ 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com